Цементный раствор: пропорции, приготовление, состав, характеристики
Цемент – один из основных строительных материалов. Представляет собой сухое порошкообразное вещество неорганического происхождения. Этот вяжущий материал при взаимодействии с водой образует пластичную смесь, которая при затвердевании превращается в камневидное тело.
Наиболее распространенная разновидность цемента – портландцемент, в состав которого входят оксиды кальция, железа, магния, диоксид кремния, глинозем. Цемент, затворенный водой, дает сильную усадку при твердении, что приводит к появлению трещин в отвердевшем продукте. Поэтому вяжущее используется в сочетании с заполнителями и наполнителями, предотвращающими растрескивание цементного камня. Наиболее популярным мелким заполнителем является песок.
Назначение строительных цементных растворов
Цементно-песчаные (и другие) строительные растворы регламентируются ГОСТом 28013-98. По назначению их разделяют на следующие виды:
- Кладочные, в том числе для монтажных работ.

- Штукатурные. Применяются для выравнивания основания и защиты стенового материала от воздействия атмосферных явлений.
- Облицовочные. Служат для облицовки вертикальных и горизонтальных строительных конструкций керамической и керамогранитной плиткой.
В зависимости от назначения цементного раствора в его составе может быть песок различных фракций.
| Назначение раствора | Крупность зерен песка, мм |
| Для кладки, кроме бутового камня | 2,5 |
| Для бутовой кладки | 5,0 |
| Для штукатурки, кроме накрывочного слоя | 2,5 |
| Для накрывочного штукатурного слоя | 1,25 |
| Для облицовочного слоя | 1,25 |
В соответствии с ГОСТом 28013-98 цементные растворы различаются по маркам прочности на сжатие.
Таблица областей применения в зависимости от марки прочности цементного раствора
| Марки по прочности на сжатие | Области применения |
| М50 | |
| М75 | Внутренние кладочные работы |
| М100 | Наружная кладка кирпича и блоков, устройство стяжки пола |
| М150 | Заполнение швов в конструкциях из тяжелых бетонов, изготовления стяжки, при оборудовании гидротехнических объектов |
| М200 | Благодаря высокой водостойкости, продукт используют в качестве гидроизоляционного слоя; при изготовлении материала для конструкций, которые в процессе эксплуатации будут контактировать с агрессивными средами, используется сульфатостойкий цемент |
Компоненты строительных цементных растворов
Для получения качественного строительного материала каждый компонент должен соответствовать требованиям нормативов:
- Цемент.
 В общих случаях используется портландцемент марок 400 и 500 без минеральных добавок или с минеральными добавками в количестве до 20%. Для особых эксплуатационных условий применяют сульфатостойкое, гидротехническое, пластифицированное цементное вяжущее.
В общих случаях используется портландцемент марок 400 и 500 без минеральных добавок или с минеральными добавками в количестве до 20%. Для особых эксплуатационных условий применяют сульфатостойкое, гидротехническое, пластифицированное цементное вяжущее. - Песок. Должен соответствовать ГОСТу 8736-2014 «Песок для строительных работ». Для изготовления растворов используют речной и карьерный песок, очищенный от илистых и глинистых включений, снижающих качество готового продукта.
- Вода. Из питьевого трубопровода или проверенная на качество в лабораторных условиях. Температура +15…+20°C.
Цемент, песок и вода – основные компоненты строительного цементного раствора, но также в рецепт включаются добавки, придающие пластичной смеси или конечному продукту определенные свойства:
- Эластификаторы. Улучшают эластичность раствора и его адгезию к основанию, повышают устойчивость затвердевшего продукта к появлению трещин и влагостойкость.

- Пластификаторы и их более мощный вариант – суперпластификаторы. Увеличивают подвижность пластичной смеси, сокращают расход материала, уменьшают его склонность к расслоению. Наиболее простой вариант – применение моющих растворов. Их добавляют не в сухую смесь, а в воду.
- Гидроизоляторы. Такие добавки ускоряют схватывание и твердение раствора, повышают водонепроницаемость готового слоя.
- Латексные добавки. Сообщают готовому продукту широкий спектр полезных свойств – водостойкость, устойчивость к воздействию нефти и нефтепродуктов, других агрессивных химических веществ.
- Противоморозные. Применяются при ведении работ в холодный период года.
- Сажа, графит и другие красящие вещества. Не влияют на физические характеристики материала, применяются только для изменения цвета готового продукта.
Удельный вес цементно-песчаного раствора зависит от вида и пропорций составляющих, в среднем он равен 1800 кг/м3.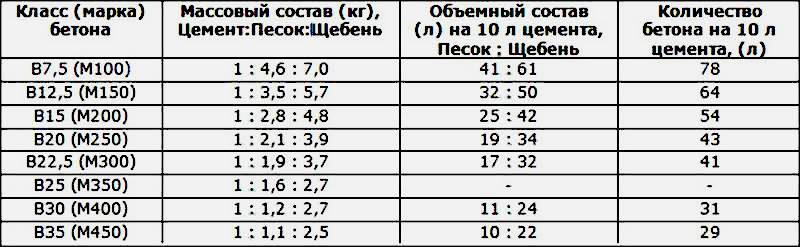
Этапы приготовления
Пропорции компонентов зависят от области применения цементного раствора, а следовательно, от марки прочности на сжатие.
Таблица пропорций компонентов раствора – цемента и песка по массе
| Марка раствора | Марка цемента | Пропорции компонентов | |
| Цемент | Песок | ||
| М50 | 1 | 7,4 | |
| М75 | М400 | 1 | 5,4 |
| М100 | М400 | 1 | 4,3 |
| М500 | 1 | 4,3 | |
| М150 | М400 | 1 | 3,25 |
| М500 | 1 | 3,9 | |
| М200 | М400 | 1 | 2,5 |
| М500 | 1 | 3 | |
При небольших объемах работ приготовление цементно-песчаного раствора возможно вручную.
Последовательность:
- Смешивают вяжущее и песок в сухом состоянии в металлической емкости или на стальном листе. Делать это на грунте не рекомендуется, поскольку состав загрязняется.
- После того как смесь приобретет однородный сероватый цвет ее сгребают в гряду или кучку, на вершине которой делают небольшое углубление. В него небольшими порциями добавляют воду.
- Полученный состав вымешивают.
Готовый продукт должен напоминать по густоте сметану, след от лопаты должен быть четким, не расплывчатым.
Приготовление материала в бетономешалке обеспечивает высокую скорость процесса и хорошее качество готовой пластичной смеси, благодаря тщательному перемешиванию и получению полностью однородного продукта.
- В барабан заливают примерно половину положенного объема воды.
 Примерное количество воды – половина от объема цемента.
Примерное количество воды – половина от объема цемента. - Перед тем как развести цемент, в воду вводят добавки, например моющее средство, которое должно полностью раствориться с образованием равномерной пены. Время перемешивания – 3-5 минут.
- В барабан добавляют цемент и половину песка. Время перемешивания – 1-3 минуты.
- Вводят остаток песка, перемешивают, регулируют плотность цементного раствора путем введения нужного количества воды.
- Последний замес – 3-5 минут.
В результате получается однородный продукт, без комков, воздушных пузырей и расслоений. Приготовленный пластичный материал не должен растекаться и рассыпаться. Для проверки его готовности комок выкладывают на ровную поверхность. Требования – из комка не должна вытекать вода, со временем он немного оседает без потери первоначальной формы.
Цементный раствор М100: характеристики, цены в Смоленске
Компания «Бетон+» предлагает компаниям Смоленска и области купить бетонный раствор М-100. Заказы на отгрузку принимаем круглосуточно. Доставляем любые объемы готового раствора на собственных автомобилях, оборудованных бетономешалками и строительными миксерами.
Заказы на отгрузку принимаем круглосуточно. Доставляем любые объемы готового раствора на собственных автомобилях, оборудованных бетономешалками и строительными миксерами.
Марка раствора | Единица измерения | Цена 1 м.куб. |
|---|---|---|
М100 | 1 м.куб. | 2400,00 |
Характеристики и состав
М-100 — цементная смесь, которую применяют для строительных и ремонтных работ. Простой раствор состоит из портландцемента, воды и заполнителя. В качестве последнего используется сеяный строительный песок однородной фракции, добытый карьерным методом. Фракция зерен песка — 1,25–2,5 мм.
Характеристики раствора и его компонентов заложены в маркировке М-100 Пк4 F50:
- прочность — до 100 кг/м3;
- показатель пластичности — 4;
- класс морозостойкости — F50.
Кладочный раствор полностью адаптирован к особенностям смоленского климата. Прочность слоя сохраняется в пределах допустимых нагрузок, указанных в действующем ГОСТ.
Прочность слоя сохраняется в пределах допустимых нагрузок, указанных в действующем ГОСТ.
Применение раствора М-100
Цементно-песчаный раствор М-100 одинаково выгоден для проведения ремонтов и возведения жилых и нежилых зданий и сооружений. Эксперты компании «Бетон+» рекомендуют выбирать раствор М-100 для:
- монтажа сборных конструкций из бетонных и железобетонных элементов;
- восстановления, стяжки и выравнивания полов, в том числе под последующее покрытия чистовым слоем;
- штукатурных работ;
- обустройства основания мягких крыш;
- кирпичной, пеноблочной, газоблочной и шлакоблочной кладки.
Исследования раствора в лаборатории предприятия и опыт его применения в разных видах работ показывают, что он в полной мере соответствует требованиям вязкости, прочности, плотности, стойкости к температурным и атмосферным воздействиям.
Почему выгодно заказывать цементный раствор у «Бетон+»?
Все поставки — от производителя
Доступная стоимость позволяет экономить бюджет, особенно при крупных заказах
Возможны скидки при постоянном сотрудничестве
Доставка оперативная — миксерами или бетономешалками в любую точку Смоленской области
Качество материала всегда на высоте
Сопутствующие товары:
+7 (4812) 68-81-50
Прием заявок по телефону:
Цементный раствор, строительный раствор.
 Марки цементного раствора, состав и приготовление
Марки цементного раствора, состав и приготовлениеПри строительстве жилых объектов с применением цементного раствора необходимо четкое соблюдение технологии изготовления применяемого раствора. И речь идет не только о марке цемента и точности пропорций составляющих цементного раствора, но и правильности замешивания, и использования готового раствора.

Строительный раствор, кладочный раствор, штукатурный раствор.
Отличаются они составом. Например, при изготовлении штукатурного раствора, должен применяться песок меньшего модуля крупности-чистый речной песок, без крупных включений в песок в виде камушков, ракушек и других включений. Кладочный раствор должен быть без зёрен щебня и крупных включений, песок можно применять-карьерный.
В состав любого цементного раствора входит цемент, вода и песок. В отличие от бетонной смеси, в этот компонент не входят щебень или гравий.
В зависимости от назначения раствора и условий его применения, раствор классифицируют на:
-штукатурный раствор марки М10, М25, М50;
-кладочный раствор, марки М50, М75, М100, М125, М150, М200;
-растворная смесь для стяжки М150, М200;
Таблица 1. Пропорции цемента и песка для производства цементного раствора различных марок:
Цемент | Цементный раствор марки «100» | Цементный раствор марки«50» | Цементный раствор марки«25» | Цементный раствор марки «10» |
Соотношение частей, цемент:песок | ||||
Марка М-400 | 1:3,5 | 1:6 | — | — |
Марка М-300 | 1:2,5 | 1:5 | — | — |
Марка М-200 | — | 1:3,5 | 1:6 | — |
Марка М-150 | — | 1:2,5 | 1:4 | 1:6 |
Однако в производственных условиях цемент удобно считать в килограммах (так как цемент продают в мешках по 25, 50 кг) , а песок в кубометрах (в 1 кубометре 100 ведер).
Таблица 2. Расход цемента в килограммах на 1 кубометр песка для производства цементного раствора различных марок:
Цемент | Цементный раствор марки«100» | Цементный раствор марки«50» | Цементный раствор марки«25» | Цементный раствор марки«10» |
Расход цемента(в кг) на 1 м³ песка | ||||
Марка М-400 | 340 | 185 | 90 | — |
Марка М-300 | 435 | 240 | 120 | — |
Марка М-200 | — | 350 | 185 | 75 |
Марка М-150 | — | — | 230 | 95 |
Цементно-известковые растворы
Такие растворы применяют при кладке и оштукатуривании фасадов зданий и внутренних помещений. Введение извести резко повышает пластичность растворов. Содержание известкового компонента зависит от назначения слоя.
Растворы на основе воздушной извести и гипса применяют для оштукатуривания поверхностей внутри помещений с относительной влажностью воздуха до 60 %. Основной недостаток известковых растворов — медленное твердение. Для ускорения их твердения добавляют строительный гипс.
Таблица 3. Состав и марки цементно-известковых и цементно-глиняных растворов:
| Марка цемента | Марка раствора, кгс/см2 | ||||
| 100 | 50 | 25 | 10 | 4 | |
| Соотношение частей раствора | |||||
| 400 | 1:0,2:3,5 | 1:0,7:6,5 | 1:1,9:12,5 | — | — |
| 300 | 1:0,1:2,5 | 1:0,4:5 | 1:1,3:10 | — | — |
| 200 | — | 1:0,2:3,5 | 1:0,7:6,5 | 1:2:16 | — |
| 150 | — | — | 1:0,3:4,5 | 1:0,8:7 | — |
| 100 | — | — | 1:0,1:3 | 1:1,5:10,5 | 1:1,8:13 |
| 50 | — | — | — | 1:0,2:3,5 | 1:1:9 |
Примечание: цифры 1:0,2:3,5 обозначают, что берут 1 часть цемента, 0,2 части известкового или глиняного теста и 3,5 части песка.
Таблица 4. Составы раствора для надземной кладки зданий с влажностью помещений до 60% и для кладки фундаментов в маловлажных грунтах:
| Марка цемента | Марка раствора | |||
| 100 | 75 | 50 | 25 | |
| Цементно-известковые растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:1:8 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | 1:1,7:1,2 |
| 300 | — | 1:0,2:3 | 1:0,4:4,5 | 1:1,2:9 |
| Цементно-глиняные растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:1:3 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | 1:1:11 |
| 300 | — | 1:0,2:3 | 1:0,4:4,5 | 1:1:9 |
Таблица 5. Составы растворов для надземной кладки с влажностью помещений более 60% и кладки фундаментов, расположенных ниже уровня грунтовых вод:
| Марка | Марка раствора | |||
| 100 | 75 | 50 | 25 | |
| Цементно-известковые растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:0,7:8 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | — |
| 300 | — | 1:0,2:3 | 1:0,4:5 | 1:0,7:9 |
| Цементно-глиняные растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:0,7:7,5 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | 1:0,7:8,5 |
| 300 | — | 1:0,2:3 | 1:0,4:5 | — |
| Цементные растворы | ||||
| 600 | 1:4,5 | 1:6 | — | — |
| 500 | 1:4 | 1:5 | — | — |
| 400 | 1:3 | 1:4 | 1:6 | — |
| 300 | — | 1:3 | 1:4,5 | — |
Материалы и растворы для фундаментов и цоколей
Таблица 6.Растворы для кладки фундаментов и цоколей, находящихся ниже гидроизоляционного слоя:
| Марка цемента | Тип грунта | |||
| маловлажный | влажный | насыщенный водой | ||
| цементно-известковый раствор марки «10» (цемент, известковое тесто, песок) | цементно-глиняный раствор марки «10» (цемент, глиняное тесто, песок) | цементно-известковый и цементно-глиняный раствор марки «25» (цемент, известь или глина, песок) | цементный раствор марки «50» (цемент, песок) | |
| 50 | 1:0,1:2,5 | 1:0,1:2,5 | — | — |
| 100 | 1:0,5:5 | 1:0,5:5 | 1:0,1:2 | — |
| 150 | 1:1,2:9 | 1:1:7 | 1:0,3:3,5 | — |
| 200 | 1:1,7:12 | 1:1:8 | 1:0,5:5 | 1:2,5 |
| 250 | 1:1,7:12 | 1:1:9 | 1:0,7:5 | 1:3 |
| 300 | 1:2,5:15 | 1:1:11 | 1:0,7:8 | 1:4,5 |
| 400 | 1:2,1:15 | 1:1:11 | 1:0,7:8 | 1:6 |
Примечание:
Составы растворов даны в объемных единицах.
Таблица 7. Материалы для подземной части дома и цоколя, находящихся ниже гидроизоляционного слоя:
| Материалы | Марка материала, кгс/см2 | ||
| Грунт | |||
| малоувлажненный | влажный | насыщенный водой | |
| при уровне грунтовых вод на глубине от поверхности земли, м | |||
| 3 и более | от 1 до 3 | 1 | |
| Камень природный, массой более 1600 кг/м3 (известняк, плотный песчаник, гранит, диорит, базальт) | 100 | 150 | 200 |
| Камень природный массой менее 1600 кг/м3 | 50 | 75 | Применять нельзя |
| Бетон тяжелый массой более 1800 кг/м3 и изделия из него, кроме бетона на топливном шлаке | 75 | 75 | 100 |
| Кирпич глиняный пластического прессования | 100 | 125 | 150 |
| Раствор цементный | Применение не оправдано | 25 | 50 |
| Раствор цементно-известковый | 10 | 25 | Применять нельзя |
| Раствор цементно-глиняный | 10 | 25 | То же |
Кладочный раствор можно готовить в бетономешалке либо вручную.
Цементный раствор готовят следующим образом: в металлическую или деревянную емкость для замеса сначала засыпают необходимое количество ведер песка ровным слоем и сверху насыпают необходимое количество цемента, затем смесь перелопачивают до однородной по цвету массы, затем поливают из лейки отмеренным количеством воды и продолжают перелопачивать до получения однородного состава.
Приготовленный раствор расходуют в течение 1,5 часов, чтобы он не потерял прочность. Песок для приготовления раствора необходимо предварительно просеять через сито с ячейками 10×10 мм (для каменной кладки).
Раствор из известкового теста готовят сразу, перемешивая его с песком и водой до однородного состава.
Цементно-известковый раствор готовят из цемента, известкового теста и песка.
Известковое тесто разводят водой до густоты молока и процеживают на сите с ячейками 10×10 мм. Из цемента и песка готовят сухую смесь, затворяют известковым молоком до требуемой густоты (консистенции теста).
Цементно- глиняный раствор готовят аналогично цементно-известковому.
Как приготовить цементный раствор своими руками, калькулятор
Здесь вы можете произвести необходимые расчеты по приготовлению раствора для кладки своими руками. Введите в графу «Объем раствора» требуемое число, выберите марку и вы получите точные пропорции цемента, песка и воды. Строительные растворы готовят для разных целей, например для кладки стен дома и кладки стен печи, рецепт приготовления несколько отличается. Будьте внимательны при расчетах.
Раствор для кладки кирпичей
Многие годы для возведения стен использовался кирпич, но развитие строительных технологий привело к тому, что на рынке появились новые материалы – блоки из газо- или пенобетона, керамические блоки, а также блоки из вспененного полистирола. Чтобы стены здания были прочными и устойчивыми к различным атмосферным воздействиям, для кладки различных видов строительного материала готовят разные растворы. Для этого используют строительные смеси с цементной, цементно-известковой или известковой основой.
Цементный раствор применяют для возведения стен из бетонных блоков, обычного или клинкерного кирпича. Нужно учесть, что марка такого раствора для кладки не должна быть выше класса прочности материала, используемого для возведения стен. Раствор должен быть пластичным, легко наноситься и не стекать со стены. Для обеспечения этих качеств в состав смеси добавляют пластификаторы, а для того, чтобы раствор сохранял водонепроницаемость швов, в него добавляют уплотняющие добавки. Особенно хорошо использовать цементный раствор для стен, которые подвергаются влиянию атмосферных осадков или находятся во влажной среде. Это могут быть стены фундамента или фасада здания, подвального помещения, стены дымоходов.
Как приготовить раствор самому?
Для получения раствора цемент смешивают песком, имеющим среднюю фракцию. Чтобы приготовить самую простую смесь к 1 части цемента добавляют 3 — 4 части чистого просеянного речного песка средней фракции. Сухой состав хорошо перемешивают, а затем понемногу наливают воду до тех пор, пока раствор не превратиться в однородную массу с необходимым уровнем подвижности. Однако такой состав быстро застывает во время кладки, поэтому для повышения пластичности и вяжущих качеств в него добавляют глину или пластификаторы. Такой раствор легче выравнивать на поверхности стены, он обеспечит лучшее уплотнение, а кладка будет выглядеть аккуратно. В качестве вяжущих присадок в смесь можно добавить небольшое количество мыла, моющих средств или стирального порошка.
Марки растворов для кладки
Раствор М25. Это цементный раствор для кладки кирпича или кладки других видов камней. Марка раствора М25, является его официальным и правильным названием, употребляется, как в специальной литературе, так и в практике строительных работ. Раствор М25 относится к смешанным (сложным) растворам для кладки. Цементный раствор М25 состоит из наполнителя для раствора, вяжущего и воды. Роль наполнителя для раствора М25 обычно играет обычный песок. При этом, чем песок чище, тем выше прочность раствора.
Раствор М50. Он является одним из наиболее популярных. Он является смешанным, сложным раствором для кладки кирпича и других видов камня, сеточной стяжки полов. М50 состоит из связующего элемента, воды и наполнителя. Наполнителем является хорошо очищенный от глины песок, что улучшает прочность цементного раствора. Связующим элементом является цемент, вода применяется, естественно, также очищенная.
Раствор М-75. Прочность цементного раствора М75 зависит от того, в каких пропорциях смешан песок с цементом, как вяжущим компонентом, и водой. М75 — это раствор высокой марки, его пропорции — 1 часть цемента к 3 частям песка и чуть менее одной части воды . Поэтому он пластичен и прочен, чем удобен в применении. Цементный раствор М75 незаменим при монтаже конструкций из сборного железобетона, заливке выравнивающих стяжек, кирпичной кладке.
Раствор М-100. Цементный раствор марки М100 применяется в основном при проведении кладочных и штукатурных работ, а так же при изготовлении цементных стяжек полов. Основное отличие раствора м 100 от бетона аналогичной марки — отсутствие крупного заполнителя (щебня) в составе смеси. Естественно, сам состав — тоже иной. Значительно большее содержание цемента и песка, нежели в бетоне аналогичной марки. Раствор М-100 также может называться как: цементный, строительный, кладочный, штукатурный раствор.
Что нужно для быстрого застывания раствора?
Чтобы увеличить время застывания состава во время кладки готовят цементно-известковый раствор. Для этого в цементно-песочную смесь добавляют известковое тесто. Сначала в емкость для приготовления наливают 2/3 части воды, затем высыпают по 1 части цемента и извести, хорошо перемешивают не менее 15 минут, затем доливают оставшуюся воду и 3 — 4 части песка. Такой раствор используют также для возведения стен из пено- и газобетона, предварительно добавив в него специальные пенные добавки, которые повысят теплоизоляцию стыковочных швов.
Известковым раствором пользуются при возведении внутренних стен или межкомнатных перегородок. Для него характерна высокая пластичность, поэтому стены будут выглядеть аккуратно. Чтобы приготовить раствор смешивают 1 часть негашеной извести с 3 — 5 частями чистого просеянного песка, смешивают до получения однородной сухой массы, а затем доливают нужное количество воды. Раствор должен быть однородным и не иметь комков.
В случае приготовления раствора для кладки, его состав зависит от качества используемых компонентов, погодных условий, температурных колебаний и определяется опытным путем в каждом конкретном случае.
Расход цемента на строительный раствор М100: пропорции, таблица
Вопрос. Здравствуйте! Планирую закупить оптом цемент для приготовления раствора. Какой примерно расход цемента идет на раствор М100? Не хочется закупать лишний цемент, который, как известно очень быстро теряет свою активность. Спасибо за ответ!
Ответ. Добрый день! Вы не сказали, какой именно бетонный раствор вы планируете готовить и для каких целей. Поэтому приведу данные по расходу цемента на тяжелый бетон марки М100 и цементно-песчаный строительный раствор М100.
Тяжелый бетон М100
В первую очередь следует определиться с маркой цемента. Нормативным документом СНиП 5.01.23-83 оговорено, что для приготовления бетона марки М100 рекомендована марка портландцемента М300, допускается марка цемента – М400 (старое наименование). Новое наименование цемента М400 – ЦЕМ I 32,5Н ПЦ.
Здесь и далее будем опираться на действующие нормативные данные. Вот, что говорит о расходе вяжущего на 1 м3 бетонного раствора нормативный документ: СНиП 5.01.23-83 «Типовые нормы расхода цемента для приготовления бетонов, сборных и монолитных бетонных, железобетонных изделий и конструкций»– расход цемента М300 на 1 м3 бетона М100 составляет 210 кг/м3.
О расходе «допускаемого» вяжущего марки ЦЕМ I 32,5Н ПЦ нормативный документ не говорит. Но, как было сказано выше, мы можем купить цемент М400. Используем эмпирические данные по расходу вяжущего М 400, и, учитывая большую прочность на сжатие, которую можно получить, применяя цемент М400 – необходимо 175 кг цемента марки ЦЕМ I 32,5Н ПЦ на 1 м3 бетонного раствора на гранитном щебне. Для приготовления бетонного раствора М100 на гравии требуется 160 кг цемента ЦЕМ I 32,5Н ПЦ на 1 м3 материала.
Цементно-песчаный раствор М100 для кладки и штукатурки
Здесь вступает в действие нормативный документ СП 82-101-98 «СВОД ПРАВИЛ ПО ПРОЕКТИРОВАНИЮ И СТРОИТЕЛЬСТВУ ПРИГОТОВЛЕНИЕ И ПРИМЕНЕНИЕ РАСТВОРОВ СТРОИТЕЛЬНЫХ».
Минимальный расход цемента ЦЕМ I 32,5Н ПЦ (М400)на приготовление 1 м3 бетонного раствора составляет – 300кг. Минимальный расход цемента ЦЕМ I 42,5Н ПЦ (М500)на приготовление 1 м3 бетонного раствора составляет – 250 кг.
Важно! В сети интернет, «гуляет» много рекомендаций по расходу цемента на приготовление бетона и раствора М100. Однако, если вы хотите получить прочную конструкцию при всех прочих равных условиях, следует отдавать предпочтение нормам регламентируемым действующими нормативными документами: ГОСТ и СНиП.
Строительные растворы. Подбор состава, приготовление и транспортирование растворов — ТехЛиб СПБ УВТ
Строительным раствором называют искусственный каменный материал, получаемый в результате твердения правильно подобранной смеси, состоящей из вяжущего, мелкого заполнителя, воды и добавок. До начала затвердевания ее называют растворной смесью.
Строительные растворы классифицируют по плотности, виду вяжущего, составу и назначению.
По средней плотности различают растворы тяжелые плотностью более 1500 кг/м и легкие плотностью менее 1500 кг/м.
По виду вяжущего растворы бывают известковые, гипсовые, цементные и на основе смешанных вяжущих. В зависимости от свойств вяжущего растворы подразделяют на воздушные, твердеющие в воздушно-сухих условиях (например, известковые, гипсовые), и гидравлические, начинающие твердеть на воздухе и продолжающие твердеть в воде или во влажных условиях.
По степени готовности растворы делят на: сухие смеси и растворные смеси, готовые к применению.
По составу растворы делят на простые и сложные (смешанные). Растворы, приготовленные на одном вяжущем, заполнителе и воде, называют простыми. Составы простых растворов обозначают двумя числами. Например, известковый раствор состава 1 : 4 означает, что в растворе на одну часть извести приходится четыре части заполнителя (песка). Растворы, приготовленные на нескольких вяжущих, заполнителе и воде, называют сложными или смешанными. Составы сложных растворов обозначают тремя числами. Например, состав известково-цементного раствора 1:1:9 обозначает, что на одну часть извести в растворе приходится одна часть цемента и девять частей заполнителя.
По назначению строительные растворы различают:
| кладочные — для каменной кладки фундаментов, стен, столбов, сводов и др., Рис.1.Кирпичная кладка |
| отделочные — для оштукатуривания стен, потолков, Рис.2. Штукатурка стен и потолка |
| защитно-декоративные — для отделки наружных поверхностей зданий и сооружений, Рис.3. Фасадная штукатурка |
| декоративные — для отделки внутри помещений;
Рис.4. Фактурная штукатурка
|
| монтажные — для заполнения и заделки швов между крупными элементами при монтаже зданий и сооружений из готовых сборных конструкций и деталей; специальные — водонепроницаемые, кислотостойкие, жаростойкие, акустические, теплоизоляционные, инъекционные, рентгенозащитные и перекачиваемые по трубопроводам. |
В составе растворов нет крупного заполнителя, поэтому в сущности они представляют собой мелкозернистые бетоны. Общие закономерности, характеризующие свойства бетона в принципе применимы и к растворам. Однако при использовании растворов надо учитывать две особенности. Во-первых, их укладывают тонкими слоями (1…2 см), не применяя механического уплотнения. Во-вторых, растворы часто наносят на пористые основания (кирпич, бетон, легкие камни и блоки из пористых горных пород), способные сильно отсасывать воду. В результате этого изменяются свойства раствора, что необходимо учитывать при определении его состава.
Подбор состава, приготовление и транспортирование растворов
Составы растворных смесей выбирают или подбирают в зависимости от назначения раствора, требуемой марки и подвижности и условий производства работ. Подобранный состав растворных смесей должен иметь необходимую подвижность (без расслоения и водоотделения при укладке) при минимальном расходе вяжущего вещества и обеспечить получение требуемой прочности в затвердевшем состоянии.
Составы строительных растворов подбирают по таблицам и расчетным путем, в обоих случаях они уточняются экспериментально применительно к конкретным материалам.
Расчетно-экспериментальный метод подбора состава раствора основан на выполнении предварительного расчета расхода составляющих (вяжущего, заполнителей, воды и добавок) на основе научно обоснованных и экспериментально проверенных зависимостей, приведенных ниже. Он применяется для подбора состава тяжелых кладочных и монтажных растворов.
Состав растворов марок 25…200 подбирают следующим образом. Для получения заданной марки раствора в случае применения вяжущих, отличающихся маркой Мвф от приведенных в 5.8 (таблица 4) СП 82-101-98 Приготовление и применение растворов строительных, расход вяжущего на 1 м3 песка определяется по формуле
где Qв — расход вяжущего с активностью по таблице 4 на 1 м3 песка, кг;
Qвф — расход вяжущего с иной активностью;
RвQв — принимается по таблице 4 для данной марки раствора.
Количество неорганических пластификаторов (известкового или глиняного теста) Vд на 1 м3 песка определяется по формуле
Vд = 0,17(1 — 0,002Qв),
где Vд — неорганическая добавка на 1 м3 песка, м.
Расчету состава раствора должно предшествовать определение активности (марки) и средней насыпной плотности цемента, зернового состава и модуля крупности песка, средней плотности неорганического пластификатора (извести или глины).
Приготовление растворов. Растворы выпускаются в виде готовых к применению или сухих смесей, затворяемых перед использованием водой.
Процесс приготовления растворной смеси состоит из дозирования исходных материалов, загрузки их в барабан растворосмесителя и перемешивания до получения однородной массы в растворосмесителях периодического действия с принудительным перемешиванием. По конструкции различают растворосмесители с горизонтальным или вертикальным лопастным валом. Последние называются турбулентными смесителями.
Растворосмесители с горизонтальным лопастным валом выпускают вместимостью по готовому замесу 30; 65; 80; 250 и 900 л. Все эти смесители, за исключением последнего, — передвижные. Вместимость по готовому замесу турбулентных смесителей, рабочим органом которых служат быстровращающиеся роторы — 65; 500 и 800 л.
Чтобы раствор обладал требуемыми свойствами, необходимо добиться однородности его состава. Для этого ограничивают минимальное время перемешивания. Средняя продолжительность цикла перемешивания для тяжелых растворов должна быть не менее 3 мин. Легкие растворы перемешивают дольше. Для облегчения данного процесса известь и глину вводят в раствор в виде известкового или глиняного молока. Известковое тесто и комовую глину для смешанных растворов использовать нельзя, так как в этом случае практически невозможно добиться однородности растворной смеси.
Для приготовления цементных растворов с неорганическими пластификаторами в растворосмеситель заливают известковое (глиняное) молоко такой консистенции, чтобы не нужно было дополнительно заливать воду, а затем засыпают заполнитель и цемент. Органические пластификаторы сначала перемешивают в растворосмесителе с водой в течение 30…45 с, а затем загружают остальные компоненты. Растворы, как правило, приготовляют на централизованных бетонорастворных заводах или растворных узлах, что обеспечивает получение продукции высокого качества. Зимой для получения растворов с положительной температурой составляющие раствора — песок и воду — подогревают до температуры не более 60 °С. Вяжущее подогревать нельзя.
Транспортирование. Растворные смеси с заводов перевозят автосамосвалами или специально оборудованным транспортом, исключающим потери цементного молока, загрязнение окружающей среды, увлажнение атмосферными осадками, снижение температуры. Дальность перевозки зависит от вида раствора, состояния дороги и температуры воздуха. Чтобы предохранить раствор от переохлаждения и замерзания зимой, кузова автомашин утепляют или обогревают отработанными газами двигателя.
На стройках растворную смесь подают к месту использования по трубам с помощью растворонасосов.
Сроки хранения растворных смесей зависят от вида вяжущего и ограничиваются сроками его схватывания. Известковые растворы сохраняют свои свойства долго (пока из них не испарится вода), а в высохший известковый раствор можно добавить воду и вторично его перемешать. Цементные растворы необходимо использовать в течение 2…4 ч; разбавление водой и повторное перемешивание схватившихся цементных растворов не допускается, так как это приводит к резкому снижению его качества, т. е. падению марки раствора.
Растворы для кладки фундаментов и цоколей ниже гидроизоляционного слоя
| Марка цемента | Тип грунта | |||
| Маловлажный | Влажный | Насыщенный водой | ||
| Цементно-известковый раствор М10 (цемент: известковое тесто: песок) | Цементно-глиняный раствор М25 (цемент: глиняное тесто: песок) | Цементно-известковый и цементно-глиняный раствор М25 (цемент: известь или глина: песок) | Цементный раствор М50 (цемент: песок) | |
| 50 | 1:0,1:2,5 | 1:0,1:2,5 | — | — |
| 100 | 1:0,5:5 | 1:0,5:5 | 1:0,1:2 | — |
| 150 | 1:1,2:9 | 1:1,7 | 1:03:3,5 | — |
| 200 | 1:1,7:12 | 1:1:8 | 1:0,5:5 | 1:2,5 |
| 250 | 1:1,7:12 | 1:1:9 | 1:0,7:5 | 1:3 |
| 300 | 1:2,1:15 | 1:1:11 | 1:0,7:8 | 1:6 |
Примечание: Составы растворов даны в объемных соотношениях. Песок принят средней крупности влажностью 2% и более. При употреблении сухого песка его дозировка уменьшается на 10%.
Цементный раствор готовится таким образом: сначала готовят сухую смесь, которую затем затворяют водой, и перемешивают. Сухие цементные растворы затворяют водой, перемешивают и используют в течение 1-1,5 часов. Воду тоже тщательно дозируют. От избытка воды получится более жидкий раствор, после высыхания он становится менее прочным, чем густой раствор такого же состава.
Цементно-известковый раствор готовят в пропорциях. Это так называемые сложные растворы, рассчитанные на работу в нормальных условиях. Поэтому для каменной кладки, располагающейся ниже уровня грунтовых вод, такие растворы применять не следует. Цементно-известковые растворы чаще всего применяют для внутренней кладки или для штукатурки подвальных помещений. Готовят его в такой последовательности.
Известковое тесто разводят до густоты молока и процеживают на чистом сите. Из цемента и песка готовят сухую смесь, затворяют ее известковым молоком и тщательно перемешивают до получения однородной массы. Добавление известкового молока повышает пластичность раствора и делает его более «теплым» (табл. 2, 3).
Состав раствора для надземной кладки с влажностью помещений менее 60%
| Марка цемента | Марка раствора | |||
| 100 | 75 | 50 | 25 | |
| Цементно-известковые растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:1:8 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:1,7:1,2 | |
| 300 | — | 1:0,2:3 | 1:0,4:4,5 | 1:1,2:9 |
| Цементно-глиняные растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,4:4,5 | 1:0,7:6 | 1:1:3 | — |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | 1:1:11 |
| 300 | — | 1:0,2:3 | 1:0,4:4,5 | 1:1:9 |
Таблица 3. Состав раствора для надземной кладки с влажностью помещений более 60%
| Марка цемента | Марка раствора | |||
| 100 | 75 | 50 | 25 | |
| Цементно-известковые растворы | ||||
| 600 | 1:0,4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:0,7:8 | — |
| 400 | 1:0,2:3 | 1:0.3:4 | 1:0,7:6 | — |
| 300 | — | 1:0,2:3 | 1:0,4:4,5 | 1:0,7:9 |
| Цементно-глиняные растворы | ||||
| 600 | 1:0.4:4,5 | 1:0,7:6 | — | — |
| 500 | 1:0,3:4 | 1:0,5:5 | 1:0,7:6 | 1:0,7:8,5 |
| 400 | 1:0,2:3 | 1:0,3:4 | 1:0,7:6 | 1:0,7:8,5 |
| 300 | — | 1:0,2:3 | 1:0,4:5 | — |
| Цементные растворы | ||||
| 600 | 1:4,5 | 1:6 | — | — |
| 500 | 1:4 | 1:5 | — | — |
| 400 | 1:3 | 1:4 | 1:6 | — |
| 300 | — | 1:3 | 1:4,5 | — |
Известковый раствор получают затворением известковым молоком чистого песка без включения цемента. Обычно это растворы низких марок и большей частью используются для внутренней штукатурки жилых помещений. Такие растворы отличаются удобоукладываемостью, хорошим сцеплением с кладочным материалом. Известковые растворы твердеют медленно и для ускорения этого процесса в раствор часто добавляют гипс. Особенно возрастает необходимость введения гипса при штукатурке потолков и откосов, где к скорости твердения раствора предъявляются повышенные требования.
Для получения глиняно-известкового раствора глину и известь смешивают, а затем заливают водой. Полученной смесью затворяют песок в необходимой пропорции. Такие растворы применяют в летних условиях для надземной кладки преимущественно в сухом климате при нормальной влажности воздуха помещений.
| Составы цементноизвестковых, цементноглиняных и цементных растворов | |||||
| Марка раствора | Составы в объемной дозировке растворов при марке вяжущего | ||||
500 | 400 | 300 | 200 | 150 | |
| Составы цементноизвестковых и цементноглиняных растворов для надземных конструкций при относительной влажности воздуха помещений до 60% и для фундаментов в маловлажных грунтах | |||||
| 300 | 1 : 0,15 : 2,1 | 1 : 0,07 : 1,8 | — | — | — |
| 200 | 1 : 0,2 : 3 | 1 : 0,1 : 2,5 | — | — | — |
| 150 | 1 : 0,3 : 4 | 1 : 0,2 : 3 | 1 : 0,1 : 2,5 | — | — |
| 100 | 1 : 0,5 : 5,5 | 1 : 0,4 : 4,5 | 1 : 0,2 : 3,5 | — | — |
| 75 | 1 : 0,8 : 7 | 1 : 0,5 : 5,5 | 1 : 0,3 : 4 | 1 : 0,1 : 2,5 | — |
| 50 | — | 1 : 0,9 : 8 | 1 : 0,6 : 6 | 1 : 0,3 : 4 | — |
| 25 | — | — | 1 : 1,4 : 10,5 | 1 : 0,8 : 7 | 1 : 0,3 : 4 |
| 10 | — | — | — | — | 1 : 1,2 : 9,5 |
| Составы цементноизвестковых и цементноглиняных растворов для надземных конструкций при относительной влажности воздуха помещений свыше 60% и для фундаментов во влажных грунтах | |||||
| 300 | 1 : 0,15 : 2,1 | 1 : 0,07 : 1,8 | — | — | — |
| 200 | 1 : 0,2 : 3 | 1 : 0,1 : 2,5 | — | — | — |
| 150 | 1 : 0,3 : 4 | 1 : 0,2 : 3 | 1 : 0,1 : 2,5 | — | — |
| 100 | 1 : 0,5 : 5,5 | 1 : 0,4 : 4,5 | 1 : 0,2 : 3,5 | — | — |
| 75 | 1 : 0,8 : 7 | 1 : 0,5 : 5,5 | 1 : 0,3 : 4 | 1 : 0,1 : 2,5 | — |
| 50 | — | 1 : 0,9 : 8 | 1 : 0,6 : 6 | 1 : 0,3 : 4 | — |
| 25 | — | — | 1 : 1 : 10,5 / 1 : 1 : 9* | 1 : 0,8 : 7 | 1 : 0,3 : 4 |
| 10 | — | — | — | — | 1 : 1 : 9 / 1 : 0,8 : 7* |
| Составы цементных растворов для фундаментов и других конструкций, расположенных в насыщенных водой грунтах и ниже уровня грунтовых вод | |||||
| 300 | 1 : 0 : 2,1 | 1 : 0 : 1,8 | — | — | — |
| 200 | 1 : 0 : 3 | 1 : 0 : 2,5 | — | — | — |
| 150 | 1 : 0 : 4 | 1 : 0 : 3 | 1 : 0 : 2,5 | — | — |
| 100 | 1 : 0 : 5,5 | 1 : 0 : 4,5 | 1 : 0 : 3,0 | — | — |
| 75 | 1 : 0 : 6 | 1 : 0 : 5,5 | 1 : 0 : 4 | 1 : 0 : 2,5 | — |
| 50 | — | — | 1 : 0 : 6 | 1 : 0 : 4 | — |
| * Над чертой — составы цементноизвестковых растворов, под чертой — цементноглиняных. Цемент : Известь (Глина) : Песок. Песок принят по ГОСТ 8736 с естественной влажностью 3–7% | |||||
| Выбор вяжущих при приготовлении растворов для каменных кладок | |
| Условия эксплуатации конструкций | Вид вяжущего |
| 1 Для надземных конструкций при относительной влажности воздуха помещений до 60% и для фундаментов, возводимых в маловлажных грунтах | Портландцемент, пластифицированный и гидрофобный портландцементы, шлакопортландцемент, пуццолановый портландцемент, цемент для растворов, известковошлаковое вяжущее |
| 2 Для надземных конструкций при относительной влажности воздуха помещений свыше 60% и для фундаментов, возводимых во влажных грунтах | Пуццолановый портландцемент, пластифицированный и гидрофобный портландцементы, шлакопортландцемент, портландцемент, цемент для растворов, известковошлаковые вяжущее |
| 3 Для фундаментов при агрессивных сульфатных водах | Сульфатостойкие портландцементы, пуццолановый портландцемент |
| Ориентировочные расходы вяжущего на 1 м³ песка или на 1 м³ раствора | ||||
| Вяжущие | Марка раствора Mр | Марка вяжущего Мв | Расход вяжущего, кг | |
на 1 м³ песка | на 1 м³ раствора | |||
| ГОСТ 10178 ГОСТ 25328 ГОСТ 22266 | 300 | 500 | 460 | 510 |
400 | 575 | 600 | ||
200 | 500 | 360 | 410 | |
400 | 450 | 490 | ||
150 | 500 | 280 | 330 | |
400 | 350 | 400 | ||
300 | 470 | 510 | ||
100 | 500 | 205 | 250 | |
400 | 255 | 300 | ||
300 | 340 | 390 | ||
75 | 500 | 160 | 195 | |
400 | 200 | 240 | ||
300 | 270 | 310 | ||
200 | 405 | 445 | ||
50 | 400 | 140 | 175 | |
300 | 185 | 225 | ||
200 | 280 | 325 | ||
25 | 300 | 105 | 135 | |
200 | 155 | 190 | ||
10 | 150 | 93 | 110 | |
100 | 140 | 165 | ||
50 | 280 | 320 | ||
4 | 50 | 120 | 145 | |
25 | 240 | 270 | ||
| Расход вяжущих указан для смешанных цементно известковых и цементноглиняных растворов и песка в рыхлонасыпанном состоянии при естественной влажности 3–7%. | ||||
Растворы штукатурные и для крепления облицовочных плиток
| Вид и состав раствора для подготовительных слоев наружных и внутренних штукатурок (обрызг и грунт) | ||||
| Вид оштукатуриваемой поверхности | Вид и состав раствора | |||
цементного | цементно-известкового | известкового | известково-гипсового | |
| Наружная штукатурка стен, цоколей, карнизов и т.п., подвергающихся систематическому увлажнению, а также внутренняя штукатурка в помещениях с относительной влажностью воздуха свыше 60% | ||||
| Для обрызга | ||||
| Каменные и бетонные | от 1 : 2,5 | от 1 : 0,3 : 3 | — | — |
| Для грунта | ||||
| Каменные и бетонные | от 1 : 2 | от 1 : 0,7 : 2,5 | — | — |
| Наружная штукатурка стен, не подверженных систематическому увлажнению, и внутренняя штукатурка в помещениях с относительной влажностью воздуха до 60% | ||||
| Для обрызга | ||||
| Каменные и бетонные. Деревянные и гипсовые | — | от 1 : 0,5 : 4 | от 1 : 2,5 | от 1 : 0,3 : 2 |
| Для грунта | ||||
| Каменные и бетонные. Деревянные и гипсовые | — | от 1 : 0,7 : 3 | от 1 : 2 | от 1 : 0,5 : 1,5 |
| Вид и состав раствора для отделочного слоя (накрывки) наружных и внутренних штукатурок | ||||
| Вид грунта оштукатуриваемых поверхностей | Вид и состав раствора | |||
цементного | цементно-известкового | известкового | известково-гипсового | |
| Наружная штукатурка стен, цоколей, карнизов и т.п., подвергающихся систематическому увлажнению, а также внутренняя штукатурка в помещениях с относительной влажностью воздуха свыше 60% | ||||
| Цементный и цементно-известковый | от 1 : 1 | от 1 : 1 : 1,5 | — | — |
| Наружная штукатурка стен, не подверженных систематическому увлажнению, и внутренняя штукатурка в помещениях с относительной влажностью воздуха до 60 % | ||||
| Цементный и цементно-известковый | — | от 1 : 1 : 2 | — | — |
| Известковый и известково-гипсовый | — | — | от 1 : 1 | от 1 : 1 : 0 |
| Вяжущее1 : Вяжущее2 : Песок. Песок принят по ГОСТ 8736 с естественной влажностью 3–7% | ||||
Читать по теме:
К разделу
Строительные материалы
Цементный раствор
| Цена на РАСТВОР | |
| Наименование продукции | Цена |
| М 50 | 1850 |
| М 75 | 1950 |
| М 100 | 2250 |
| М 150 | 2450 |
| М 200 | 2650 |
Специализация компании «Нижстройбетон» — доставка штукатурного, кладочного раствора, используемого при кирпичной кладке.
Наше главное преимущество – это наличие контрактов с крупнейшими поставщиками. Соответственно, в наличии имеется любая продукция, которую Вы можете заказать у нас: бетон, цементный раствор.
Каждый строительный материал имеет свою специфику и особенности. Даже похожие на первый взгляд вещества имеют разный состав и назначение. Цементный раствор очень похож на бетон, но все же имеет отличия.
Бетон состоит из четырех компонентов – это цемент, вода, мелкофракционный заполнитель, например, песок, и крупный наполнитель, например, щебень. Путем смешивания элементов в определенной пропорции получается композиционный состав, который при застывании превращается в твердую массу. Цементный раствор путают с бетоном, так как состав их почти идентичен – в цементном растворе отсутствуют крупные фракции.
Выбор цементного раствора
Цементные растворы предназначены для разных целей: от оштукатуривания стены до заливки фундаментов. В зависимости от эксплуатационных характеристик выделяют следующие марки цементных растворов:
- М50. Это так называемый «легкий» бетон, который применяют для затирки швов, выравнивания разных поверхностей.
- М75. Раствор данной марки применяется редко, его можно использовать для кладки кирпича во внутренних помещениях.
- М100-М150. Это универсальные цементные растворы, которые пользуются самой высокой популярностью среди всех марок. Они подходят и для внутренней, и для наружной кладки кирпича, с их помощью можно штукатурить стены. Если в состав цементного раствора М100 или М150 добавить песок более крупной фракции, то можно сделать прочную бетонную стяжку.
- М200. Это «тяжелый» бетон, который используется для заливки фундаментов и стяжек.
Выбирать цементный раствор нужно в зависимости от целей, для которых вы хотите его использовать.
Кладочный раствор
Если раньше для кладки кирпича необходимо было вручную смешивать все компоненты, то сегодня существуют сухие смеси. Кладочный раствор М50-М75 подходит лишь для внутренних работ или для малоэтажных строений.
Наиболее востребованными в кладочных работах являются марки М100 и М150. С их помощью можно возводить сложные и многоэтажные конструкции. Цементный раствор марки М200 для кладки применяется крайне редко, его используют только на промышленных объектах, где окружающая среда крайне агрессивна.
Известковый раствор для штукатурки
Для оштукатуривания стен в цементный раствор добавляется известь. Кроме того, если планируется отделка наружных стен, то необходимо наличие специальных присадок, которые придают раствору влагонепроницаемость и стойкость. Известковый раствор М50 подходит для финишной затирки, применяется только при внутренней отделке. М100 может быть использован в качестве основного слоя. Раствор М150 подходит для фасада, цоколя, помещений с повышенной влажностью.
Доставка раствора
Наша компания предлагает свои услуги по доставке цементного раствора. Мы предлагаем богатый ассортимент растворов разных марок, так как сотрудничаем напрямую с крупными производителями продукции. Если вы заказываете раствор, доставка осуществляется в заранее оговоренное время по указанному адресу.
Компания «Нижстройбетон» осуществляет производство стройматериалов высокого качества и по выгодным ценам. Сегодня это полный спектр работ, которые направленные на производство, доставку бетона, бетонирование.
Основным преимуществом компании «Нижстройбетон» является наличие огромного пакета контрактов с известными и крупными поставщиками, поэтому Вы можете заказать и приобрести у нас любую продукцию. Компания «Нижстройбетон» – это преимущество, доступность и высокое качество строительных материалов, которые так необходимы во время возведения государственных, административных и частных домов и зданий. Мы предоставляем Вам возможность легко и быстро отремонтировать или построить любое сооружение.
Процентный состав по массе. Пример задачи
.Процентный состав по массе — это указание массового процента каждого элемента в химическом соединении или массового процента компонентов раствора или сплава. Этот рабочий пример химической задачи включает этапы расчета процентного состава по массе. Пример для кубика сахара, растворенного в стакане воды.
Процентный состав по массе Вопрос
Кубик сахара 4 г (сахароза: C 12 H 22 O 11 ) растворяют в 350 мл чайной чашке с водой при 80 ° C.Каков процентный состав сахарного раствора по массе?
Дано: плотность воды при 80 ° C = 0,975 г / мл.
Определение процентного состава
Процентный состав по массе — это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Как решить проблему
Шаг 1 — Определите массу растворенного вещества
Нам дали массу растворенного вещества в задаче.Растворенным веществом является кубик сахара.
масса растворенного вещества = 4 г C 12 H 22 O 11
Шаг 2 — Определите массу растворителя
Растворитель — вода 80 ° C. Используйте плотность воды, чтобы найти массу.
плотность = масса / объем
масса = плотность x объем
масса = 0,975 г / мл x 350 мл
масса растворитель = 341,25 г
Шаг 3 — Определите общую массу раствора
m раствор = m растворенное вещество + m растворитель
м , раствор = 4 г + 341.25 г
м , раствор = 345,25 г
Шаг 4 — Определите массовый процентный состав сахарного раствора.
процентный состав = (m растворенного вещества / m раствора ) x 100
процентный состав = (4 г / 345,25 г) x 100
процентный состав = (0,0116) x 100
процентный состав = 1,16%
Ответ:
Массовый процентный состав сахарного раствора равен 1.16%
Советы для успеха
- Важно помнить, что вы используете общую массу раствора, а не только массу растворителя. Для разбавленных растворов это не имеет большого значения, но для концентрированных растворов вы получите неправильный ответ.
- Если вам дана масса растворенного вещества и масса растворителя, жизнь проста, но если вы работаете с объемами, вам нужно использовать плотность, чтобы найти массу. Помните, что плотность зависит от температуры. Маловероятно, что вы найдете значение плотности, соответствующее вашей точной температуре, поэтому ожидайте, что этот расчет внесет небольшую ошибку в ваш расчет.
Процент по массе и процент по объему: Численные задачи
Наука> Химия> Растворы и их совокупные свойства> Процентный составВ этой статье мы научимся вычислять массовые и объемные проценты раствора.
Задачи в массовых процентах
Пример — 01:
6 г мочевины растворяли в 500 г воды. Рассчитайте массовое процентное содержание мочевины в растворе.
Дано: Масса растворенного вещества (мочевины) = 6 г, Масса растворителя (воды) = 500 г
Найти: Массовый процент =?
Решение:
Масса раствора = Масса растворенного вещества + Масса растворителя = 6 г + 500 г = 506 г
Массовый процент мочевины = (Масса растворенного вещества / Масса раствора) x 100
= (6/506) x 100 = 1,186%
Пример — 02:
34,2 г глюкозы растворяют в 400 г воды.Рассчитайте массовый процент раствора глюкозы.
Дано: Масса растворенного вещества (глюкоза) = 34,2 г, Масса растворителя (вода) = 400 г
Кому Находим: Процент по массе =?
Решение:
Масса раствора = Масса растворенного вещества + Масса растворителя = 34,2 г + 400 г = 434,2 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
= (34,2 / 434,2) x 100 = 7,877%
Пример — 03:
Раствор получают растворением 15 г тростникового сахара в 60 г воды.Рассчитайте массовый процент каждого компонента раствора.
Дано: Масса растворенного вещества (тростниковый сахар) = 15 г, Масса растворителя (вода) = 60 г
Найти: Массовый процент тростникового сахара и воды =?
Решение:
Масса раствора = масса растворенного вещества + масса растворителя = 15 г + 60 г = 75 г
Массовый процент растворенного вещества c (тростниковый сахар) = (Масса растворенного вещества / Масса раствора) x 100
Массовый процент растворенного вещества (тростниковый сахар) = (15 г / 75 г) x 100 = 20%
Массовый процент растворителя (воды) = 100-20 = 80%
Пример — 04:
Рассчитайте массовую долю бензола и четыреххлористого углерода, если 22 г бензола растворить в 122 г четыреххлористого углерода.
Дано: Масса растворенного вещества (бензол) = 22 г, Масса растворителя (углерод тетрахлорид) = 122 г.
Кому Находим: Массовая доля бензола и четыреххлористый углерод.
Решение:
Масса раствора = масса растворенного вещества + масса растворителя
Масса раствора = 22 г + 122 г = 144 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Массовая доля бензола = (22 г / 144 г) x 100 = 15.28%
Процент тетрахлорметана по массе = 100 — 15,28 = 84,72%
Пример — 05:
Раствор получают растворением определенного количества растворенного вещества в 500 г воды. Массовая доля растворенного вещества в растворе составляет 2,38. Рассчитать массу растворенного вещества
Дано: Масса растворителя = 400 г, массовый процент = 2,38
Кому Найти: Масса растворенного вещества =?
Решение:
Пусть масса растворенного вещества = x g
Масса раствора = Масса растворенного вещества + Масса растворителя = x г + 500 г = (x + 500) г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
2.38 = (х г / (х + 500) г) х 100
2,38 (x + 500) = 100x
2.38x + 1190 = 100x
1190 = 97,62 х
x = 1190 / 97,62 = 12,19 г
Масса растворенного вещества 12,19 г
Пример — 06:
Рассчитайте массу тростникового сахара и воды, необходимую для приготовления 250 г 25% раствора тростникового сахара.
Дано: 250 г 25% раствора тростникового сахара
Кому Найдите: Масса тростникового сахара и воды =?
Решение:
Пусть масса тростникового сахара = x г
Масса раствора = 250 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
25 = (x г / 250 г) x 100
25 x 250 г = 100x
6250 г = 100x
х = 6250 г / 100 = 62.5 г
Масса тростникового сахара = 62,5 г
Масса воды = 250 г — 62,5 г = 187,5 г
Пример — 07:
В 100 мл раствора присутствует 15 г метилового спирта. Если плотность раствора составляет 0,96 г, мл -1 . Рассчитайте массовую долю раствора метилового спирта.
Дано: Масса растворенного вещества (метиловый спирт) = 15 г, Объем раствора = V = 100 мл, плотность раствора = d = 0,96 г мл -1 .
Кому Находим: массового процента метилового спирта =?
Решение:
Масса раствора = объем x плотность = 100 мл x 0,96 г мл -1 = 96 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Массовая доля бензола = (15 г / 96 г) x 100 = 15,625%
Пример — 08:
Плотность раствора соли Х составляет 1,15 г / мл -1 . После полного упаривания 20 мл раствора получают 4 остатка.6 г соли. Рассчитайте массовый процент растворенного вещества в растворе.
Дано: Объем раствора = V = 20 мл, плотность раствора = d = 1,15 г / мл, масса растворенного вещества = 4,6 г
Кому Находят: массовых процента растворенного вещества в решение =?
Решение:
Масса раствора = объем x плотность = 20 мл x 1,15 г мл -1 = 23 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Процент растворенного вещества по массе = (4.6 г / 23 г) x 100 = 20%
Пример — 09:
40% по массе мочевины получают при растворении 190 г мочевины в 400 мл воды. Рассчитайте плотность раствора.
Дано: % по массе раствора мочевины = 40% по массе растворителя. (вода) = 400 мл.
Кому Найти: Плотность раствора =?
Решение:
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Масса раствора = (Масса растворенного вещества / Процент по массе) x 100
Масса раствора = (190 г / 40) x 100 = 475 г
Объем растворителя (воды) = 400 мл = Объем раствора
Плотность раствора = масса раствора / объем раствора
Плотность раствора = (475 г) / (400 мл) = 1.19 г мл -1
Пример — 10:
Рассчитайте процентный состав по массе раствора, полученного смешиванием 300 г 25% раствора NH 4 NO 3 с 400 г 40% раствора растворенного вещества X.
Дано: 300 г 25% раствора NH 4 NO 3 смешанный с 400 г 40% раствора растворенного вещества X
Кому Находим: процентного состава в с точки зрения массы =?
Решение:
Рассмотрим 300 г 25% раствора NH 4 NO 3
Масса растворенного вещества в этом растворе = 25% от 300 г = (25/100) x 300 г = 75 г
Рассмотрим 400 г 40% раствора растворенного вещества X
Масса растворенного вещества в этом растворе = 40% от 400 г = (40/100) x 400 г = 160 г
Теперь рассмотрим решение, полученное при смешивании
Общая масса растворенного вещества = W B = 75 г + 160 г = 235 г
Общая масса раствора = W A = 300 г + 400 г = 700 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Процент растворенного вещества по массе = (235 г / 700 г) x 100 = 33.57%
Массовая доля растворителя = 100 — 33,57 = 66,43%
Пример — 11:
Рассчитать процентный состав в пересчете на массу раствора, полученного при смешивании 100 г 30% раствора NaOH с 150 г 40% раствора NaOH.
Дано: 100 г 30% раствора NaOH смешать со 150 г 40% раствор NaOH
Кому Находим: процентного состава в с точки зрения массы =?
Решение:
Рассмотрим 100 г 30% раствора NaOH
Масса растворенного вещества в этом растворе = 30% от 100 г = (30/100) x 100 г = 30 г
Рассмотрим 150 г 40% раствора NaOH
Масса растворенного вещества в этом растворе = 40% от 150 г = (40/100) x 150 г = 60 г
Теперь рассмотрим решение, полученное при смешивании
Общая масса растворенного вещества = W B = 30 г + 60 г = 90 г
Общая масса раствора = W A = 100 г + 150 г = 250 г
Массовый процент = (Масса растворенного вещества / Масса раствора) x 100
Процент растворенного вещества по массе = (90 г / 250 г) x 100 = 36%
Массовая доля растворителя = 100 — 36 = 64%
Задачи в процентах к объему :
Пример — 12:
12.8 см 3 бензола растворяют в 16,8 см 3 ксилола. Рассчитайте объемное процентное содержание бензола.
Дано: Объем растворенного вещества = 12,8 см 3 , Объем растворитель = 16,8 см 3
Кому Находим: Объем в процентах =?
Решение:
Объем раствора = Объем растворенного вещества + Объем растворителя
Объем раствора = 12,8 см 3 + 16,8 см 3 = 29.6 см 3
Процент по объему = (Объем растворенного вещества / Объем раствора) х 100
Процент бензола по объему = (12,8 см 3 / 29,6 см 3 ) x 100 = 43,24%
Пример — 13:
58 см 3 этилового спирта растворяли в 400 см 3 воды с образованием 454 см 3 раствора этилового спирта. Рассчитайте объемное процентное содержание этилового спирта в воде. (12,78% к объему)
Дано: Объем растворенного вещества = 58 см 3 , Объем раствор = 454 см 3
Кому Находим: Объем в процентах =?
Решение:
Процент по объему = (Объем растворенного вещества / Объем раствора) х 100
Процент этилового спирта по объему = (58 см 3 /454 см 3 ) x 100 = 12.78%
Предыдущая тема: Концентрация раствора
Следующая тема: Численные задачи на мольную долю
Наука> Химия> Растворы и их совокупные свойства> Процентный состав13,5: Концентрация раствора — массовый процент
Цели обучения
- Выразите количество растворенного вещества в растворе в различных единицах концентрации.
Чтобы точно определить раствор, нам нужно указать его концентрацию: сколько растворенного вещества растворено в определенном количестве растворителя.Такие слова, как разбавленный или концентрированный , используются для описания растворов, которые содержат мало или много растворенного вещества, соответственно, но это относительные термины, значения которых зависят от различных факторов.
Введение
Концентрация — это мера того, сколько одного вещества смешано с другим веществом. Говорят, что растворы либо разбавленные, либо концентрированные. Когда мы говорим, что уксус — это \ (5 \% \) уксусная кислота в воде, мы даем концентрацию.Если бы мы сказали, что смесь была \ (10 \% \) уксусной кислотой, она была бы более концентрированной, чем раствор уксуса.
Рисунок \ (\ PageIndex {1} \): Раствор слева более концентрирован, чем раствор справа, потому что в нем большее соотношение растворенных веществ (красные шарики) и частиц растворителя (синие шарики). Частицы раствора расположены ближе друг к другу. Раствор справа более разбавленный (менее концентрированный). (CC-SA-BY-3.0 Трейси Поулсен).Концентрированный раствор — это раствор, в котором присутствует большое количество растворенного вещества в данном количестве растворителя.Разбавленный раствор — это раствор, в котором небольшое количество растворенного вещества присутствует в данном количестве растворителя. Разбавленный раствор — это концентрированный раствор, который, по сути, разбавлен водой. Подумайте о контейнерах для замороженного сока, которые вы покупаете в продуктовом магазине. Чтобы приготовить сок, вам нужно смешать замороженный концентрат сока из этих контейнеров с водой, в три или четыре раза превышающей размер контейнера. Следовательно, вы разбавляете концентрированный сок. Что касается растворенного вещества и растворителя, концентрированный раствор имеет много растворенного вещества по сравнению с разбавленным раствором, в котором количество растворенного вещества меньше.
Термины «концентрированный» и «разбавленный» обеспечивают качественные методы описания концентрации. Хотя качественные наблюдения необходимы и имеют место во всех областях науки, включая химию, на протяжении всего нашего изучения науки мы видели, что существует определенная потребность в количественных измерениях в науке. Это особенно верно в химии растворов. В этом разделе мы исследуем некоторые количественные методы выражения концентрации раствора.
Массовый процент
Есть несколько способов выразить концентрацию раствора в процентах.Массовый / массовый процент (% м / м) определяется как масса растворенного вещества, деленная на массу раствора, умноженную на 100:
.\ [\ mathrm {\% \: m / m = \ dfrac {масса \: of \: solute} {масса \: of \: solution} \ times100 \%} \]
масса раствора = масса растворенного вещества + масса растворителя
Если вы можете измерить массы растворенного вещества и раствора, определение массового процента легко. Каждая масса должна быть выражена в одних и тех же единицах, чтобы определить правильную концентрацию.
Предположим, что раствор был приготовлен растворением \ (25.0 \: \ text {g} \) сахара в \ (100.0 \: \ text {g} \) воды.
Масса раствора
масса раствора = 25,0 г сахара + 100,0 г воды = 125,0 г
Массовый процент рассчитывается по формуле:
\ [\ text {Массовый процент} = \ frac {25.0 \: \ text {g сахара}} {125.0 \: \ text {g solution}} \ times 100 \% = 20.0 \% \: \ text {сахар } \]
Пример \ (\ PageIndex {1} \)
В физиологическом растворе массой 355 г их 36.В нем растворено 5 г NaCl. Какова массовая / массовая концентрация раствора?
Решение
Мы можем заменить величины, указанные в уравнении для масс / массовых процентов:
\ (\ mathrm {\% \: m / m = \ dfrac {36,5 \: g} {355 \: g} \ times100 \% = 10,3 \%} \)
Упражнение \ (\ PageIndex {1} \)
Раствор декстрозы (также называемый D-глюкозой, C 6 H 12 O 6 ) с массой 2,00 × 10 2 г имеет 15.В нем растворено 8 г декстрозы. Какова массовая / массовая концентрация раствора?
- Ответ
7,90%
Использование массовых процентов в расчетах
Иногда вам может потребоваться составить определенную массу раствора с заданным процентом по массе и вам нужно рассчитать, какую массу растворенного вещества использовать. Использование массового процента в качестве преобразования может быть полезно в этом типе задач. Массовый процент может быть выражен как коэффициент преобразования в виде \ (\ frac {g \; \ rm {solute}} {100 \; \ rm {g solution}} \) или \ (\ frac {100 \; \ rm g solution} {g \; \ rm {solute}} \)
Например, если вам нужно сделать \ (3000.0 \: \ text {g} \) \ (5.00 \% \) раствора хлорида натрия необходимо определить массу растворенного вещества.
Решение
Дано: 3000,0 г раствора NaCl
5,00% раствор NaCl
Найти: Масса растворенного вещества =? г NaCl
Другие известные количества: 5,00 г NaCl на 100 г раствора
Соответствующий коэффициент преобразования (на основе данного массового процента) может быть использован следующим образом:
Чтобы найти массу NaCl, полученная масса раствора умножается на коэффициент пересчета.
\ [г NaCl = 3,000,0 \ cancel {g \: NaCl \: solution} \ times \ frac {5.00 \: g \: NaCl} {100 \ cancel {g \: NaCl \: solution}} = 150,0 г \: NaCl \]
Вам нужно будет взвесить \ (150 \: \ text {g} \) из \ (\ ce {NaCl} \) и добавить его в \ (2850 \: \ text {g} \) воды. Обратите внимание, что необходимо было вычесть массу \ (\ ce {NaCl} \) \ (\ left (150 \: \ text {g} \ right) \) из массы раствора \ (\ left (3000 \ : \ text {g} \ right) \), чтобы вычислить массу воды, которую необходимо добавить.
Упражнение \ (\ PageIndex {1} \)
Какое количество (в г) перекиси водорода (H 2 O 2 ) необходимо для приготовления 6,00 кг, 3,00% (по массе) раствора H 2 O 2 ?
Ответ
180 г H 2 O 2
Авторы и авторство
4.3: Состав растворов
Растворы представляют собой гомогенных смесей , содержащих одно или несколько растворенных веществ в растворителе .Растворитель, из которого состоит большая часть раствора, тогда как растворенное вещество — это вещество, растворенное внутри растворителя.
Единицы относительной концентрации
Концентрации часто выражаются в единицах относительных единиц (например, в процентах) с обычно используемыми тремя различными типами процентных концентраций:
- Массовый процент : Массовый процент используется для выражения концентрации раствора, когда масса растворенного вещества и масса раствора даны: \ [\ text {Mass Percent} = \ dfrac {\ text {Масса растворенного вещества}} {\ text {Масса раствора}} \ times 100 \% \ label {1} \]
- Объемный процент : Объемный процент используется для выражения концентрации раствора, когда объем растворенного вещества и объем раствора заданы: \ [\ text {Volume Percent} = \ dfrac {\ text {Объем Раствор}} {\ text {Объем раствора}} \ times 100 \% \ label {2} \]
- Массовый / объемный процент: Другой вариант процентной концентрации — массовый / объемный процент, который измеряет массу или вес растворенного вещества в граммах (например,г., в граммах) по сравнению с объемом раствора (например, в мл). Примером может служить раствор 0,9% (вес / объем) \ (NaCl \) в медицинских солевых растворах, который содержит 0,9 г \ (NaCl \) на каждые 100 мл раствора (см. Рисунок ниже). Процент массы / объема используется для выражения концентрации раствора, когда даны масса растворенного вещества и объем раствора. Поскольку числитель и знаменатель имеют разные единицы измерения, эта единица измерения концентрации не является истинной относительной единицей (например, процентной долей), однако ее часто используют в качестве простой единицы измерения концентрации, поскольку объемы растворителя и растворов легче измерить, чем веса.Более того, поскольку плотность разбавленных водных растворов близка к 1 г / мл, если объем раствора измеряется в мл (согласно определению), то это хорошо приближает массу раствора в граммах (что составляет истинную относительную единицу (м / м)).
\ [\ text {Масса / Объем в процентах} = \ dfrac {\ text {Масса растворенного вещества (г)}} {\ text {Объем раствора (мл)}} \ times 100 \% \ label {3} \ ]
Рисунок использован с разрешения Википедии.Пример \ (\ PageIndex {1} \): «Доказательство» алкоголя как единица концентрации
Например, в Соединенных Штатах содержание алкоголя в спиртных напитках определяется как удвоенное процентное содержание алкоголя по объему (об. / Об.), Называемое доказательством.Какая концентрация алкоголя в спиртных напитках Bacardi 151 , которые продаются с крепостью 151 (отсюда и название)?
Рисунок: почти пустая бутылка Bacardi 151. из Википедии.Решение
Он будет иметь содержание алкоголя 75,5% (мас. / Мас.) В соответствии с определением «доказательство».
При вычислении этих процентных соотношений единицы растворенного вещества и раствора должны быть эквивалентными (а вес / объемный процент (вес / объем%) определяется в граммах и миллилитрах).
| Вы НЕ МОЖЕТЕ подключить… | Невозможно подключить… |
|---|---|
| (2 г растворенного вещества) / (1 кг раствора) | (2 г растворенного вещества) / (1000 г раствора) |
| или (0,002 кг растворенного вещества) / (1 кг раствора) | |
| (5 мл растворенного вещества) / (1 л раствора) | (5 мл растворенного вещества) / (1000 мл раствора) |
| или (0.005 л растворенного вещества) / (1 л раствора) | |
| (8 г растворенного вещества) / (1 л раствора) | (8 г растворенного вещества) / (1000 мл раствора) |
| или (0,008 кг растворенного вещества) / (1 л раствора) |
Единицы концентрации разбавленных
Иногда, когда растворы слишком разбавлены, их процентные концентрации оказываются слишком низкими. Таким образом, вместо использования действительно низких процентных концентраций, таких как 0,00001% или 0.000000001%, мы выбираем другой способ выражения концентраций. Следующий способ выражения концентраций похож на рецепты приготовления. Например, в рецепте вы можете использовать 1 часть сахара и 10 частей воды. Как вы знаете, это позволяет вам использовать в своем уравнении такие количества, как 1 стакан сахара + 10 стаканов воды. Однако вместо использования рецепта «1 часть на десять» химики часто используют частей на миллион , частей на миллиард или частей на триллион для описания разбавленных концентраций.
- Частей на миллион : Концентрация раствора, содержащего 1 г растворенного вещества и 1000000 мл раствора (то же самое, что и 1 мг растворенного вещества и 1 л раствора), создаст очень небольшую процентную концентрацию. Поскольку такой раствор был бы настолько разбавленным, плотность раствора хорошо аппроксимируется плотностью растворителя; для воды это 1 г / мл (но будет другим для разных растворителей). Итак, после выполнения вычислений и преобразования миллилитров раствора в граммы раствора (при условии, что растворителем является вода): \ [\ dfrac {\ text {1 г растворенного вещества}} {\ text {1000000 мл раствора}} \ times \ dfrac {\ text {1 мл}} {\ text {1 г}} = \ dfrac {\ text {1 г растворенного вещества}} {\ text {1000000 г раствора}} \] Получаем (1 г растворенного вещества) / (1000000 г решение).Поскольку и растворенное вещество, и раствор теперь выражены в граммах, теперь можно сказать, что концентрация растворенного вещества составляет 1 часть на миллион (ppm). \ [\ text {1 ppm} = \ dfrac {\ text {1 мг растворенного вещества}} {\ text {1 л раствора}} \] Единицу ppm также можно использовать в единицах объема / объема (об. / об.). (см. пример ниже).
- Частей на миллиард : Частей на миллиард (ppb) почти как ppm, за исключением того, что 1 ppb в 1000 раз больше разбавленного, чем 1 ppm. \ [\ text {1 ppb} = \ dfrac {1 \; \ mu \ text {g Solute}} {\ text {1 L Solution}} \]
- Частей на триллион : Так же, как частей на миллиард, идея частей на триллион (частей на миллион) аналогична концепции частей на миллион.Однако 1 ppt — это в 1000 раз больше разбавления, чем 1 ppb, и в 1000000 раз больше, чем 1 ppm. \ [\ text {1 ppt} = \ dfrac {\ text {1 ng Solute}} {\ text {1 L Solution}} \]
Пример \ (\ PageIndex {2} \): ppm в атмосфере
Вот таблица с объемными процентами различных газов, содержащихся в воздухе. Объемный процент означает, что на 100 л воздуха приходится 78,084 л азота, 20,946 л кислорода, 0,934 л аргона и так далее; Объемный процент по массе отличается от композиции по массе или композиции по количеству молей.
| Имя элемента | Объем в процентах (об. / Об.) | частей на миллион (об. / Об.) |
|---|---|---|
| Азот | 78,084 | 780 840 |
| Кислород | 20,946 | 209 460 |
| Водяной пар | 4,0% | 40 000 |
| Аргон | 0.934 | 9,340 |
| Двуокись углерода | 0,0379 | 379 * (но быстро растет) |
| Неон | 0,008 | 8,0 |
| Гелий | 0,000524 | 5,24 |
| Метан | 0,00017 | 1,7 |
| Криптон | 0.000114 | 1,14 |
| Озон | 0,000001 | 0,1 |
| Окись азота | 0,00003 | 0,305 |
Единицы концентрации на основе молей
- Молярная доля : Мольная доля вещества — это доля всех его молекул (или атомов) от общего числа молекул (или атомов).Иногда это также может пригодиться при работе с уравнением \ (PV = nRT \). \ [\ chi_A = \ dfrac {\ text {количество молей вещества A}} {\ text {общее количество молей в растворе}} \] Также имейте в виду, что сумма мольных долей каждого из веществ в растворе равно 1. \ [\ chi_A + \ chi_B + \ chi_C \; + \; … \; = 1 \]
- Молярный процент : Молярный процент (вещества A) равен \ (\ chi_A \) в процентной форме. \ [\ text {Молярный процент (вещества A)} = \ chi_A \ times 100 \% \]
- Молярность : Молярность (M) раствора используется для представления количества молей растворенного вещества на литр раствора.\ [M = \ dfrac {\ text {Моли растворенного вещества}} {\ text {Литры раствора}} \]
- Моляльность : Моляльность (м) раствора используется для представления количества молей растворенного вещества на килограмм растворителя. \ [m = \ dfrac {\ text {Молей растворенного вещества}} {\ text {Килограммы растворителя}} \]
Уравнения молярности и моляльности отличаются только своими знаменателями.Однако это огромная разница. Как вы помните, объем варьируется в зависимости от температуры. При более высоких температурах объемы жидкостей увеличиваются, а при более низких температурах объемы жидкостей уменьшаются. Следовательно, молярность растворов также меняется при разных температурах. Это дает преимущество использования молярности перед молярностью. Использование молярности вместо молярности для лабораторных экспериментов лучше всего поможет сохранить результаты в более близком диапазоне. Поскольку объем не является частью его уравнения, он делает моляльность независимой от температуры.
Практические задачи
- В растворе присутствует 111,0 мл (110,605 г) растворителя и 5,24 мл (6,0508 г) растворенного вещества. Найдите массовый процент, объемный процент и массовый / объемный процент растворенного вещества.
- С помощью раствора, показанного на рисунке ниже, найдите молярный процент вещества C.
- 1,5 л раствор состоит из 0,25 г NaCl, растворенного в воде. Найдите его молярность.
- 0,88 г NaCl растворяют в 2.0л воды. Найдите его молярность.
Решения
1:
Массовый процент
= (Масса растворенного вещества) / (Масса раствора) x 100% |
= (6,0508 г) / (110,605 г + 6,0508 г) x 100%
= (0,0518688312) x 100%
= 5,186883121%
Массовый процент = 5,186%
Объем в процентах
= (Объем растворенного вещества) / (Объем раствора) x 100%
= (5,24 мл) / (111,0 мл + 5,24 мл) x 100%
= (0.04507
) х 100%= 4,5079%
Объем в процентах = 4,51%
Масса / объем в процентах
= (Масса растворенного вещества) / (Объем раствора) x 100%
= (6,0508 г) / (111,0 мл + 5,24 мл) x 100%
= (0,0520) x 100%
= 5,205%
Масса / Объем в процентах = 5,2054%
2. Моль C = (5 молекул C) x (1 моль C / 6,022×10 23 молекул C) = 8,30288941×10 -24 моль C
Всего молей = (24 молекулы) x (1 моль / 6.022×10 23 молекул) = 3.98538691×10 -23 моль всего
X C = (8.30288941×10 -24 моль C) / (3.98538691×10 -23 моль) = .2083333333
Молярный процент C
= X C x 100%
= (o.2083333333) x 100%
= 20,83333333
Мол. Процент C = 20%
3. Моль NaCl = (0,25 г) / (22,99 г + 35,45 г) = 0,004277 моль NaCl
Молярность
= (молей растворенного вещества) / (литры раствора)
= (0.004277 моль NaCl) / (1,5 л)
= 0,002851 M
Молярность = 0,0029M
4. Моль NaCl = (0,88 г) / (22,99 г + 35,45 г) = 0,01506 моль NaCl
Масса воды = (2,0 л) x (1000 мл / 1 л) x (1 г / 1 мл) x (1 кг / 1000 г) = 2,0 кг воды
Моляльность
= (молей растворенного вещества) / (кг растворителя)
= (0,01506 моль NaCl) / (2,0 кг)
= 0,00752
Моляльность = 0,0075 м
Список литературы
- Петруччи, Харвуд, Селедка.Общая химия: принципы и современные приложения. 8-е изд. Река Аппер Сэдл, Нью-Джерси: Пирсон / Прентис Холл, 2002. 528-531
Авторы и авторство
- Кристиан Рэй Фигероа (UCD)
Глава 7 — Растворы — Химия
Глава 7: Растворы A Стехиометрия раствора 7.1 Введение 7.2 Типы решений 7.3 Растворимость 7.4 Температура и растворимость 7.5 Влияние давления на растворимость газов: закон Генри 7,6 Твердые гидраты 7.7 Концентрация раствора 7.7.1 Молярность 7.7.2 Количество частей в решениях 7,8 Разведения 7,9 Концентрации ионов в растворе 7.10 Внимание к окружающей среде: загрязнение свинцом 7.11 Резюме 7.12 Ссылки7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один компонент не может наблюдаться независимо от другого. Решения повсюду вокруг нас. Например, воздух — это решение. Если вы живете рядом с озером, рекой или океаном, этот водоем — не чистый H 2 O, но, скорее всего, решение.Многие из того, что мы пьем, например газированные напитки, кофе, чай и молоко, являются растворами. Решения — большая часть повседневной жизни. Большая часть химии, происходящей вокруг нас, происходит в растворе. Фактически, большая часть химии, происходящей в нашем собственном организме, происходит в растворах, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны для здравоохранения. В нашем понимании химии нам нужно немного разбираться в растворах. В этой главе вы узнаете об особых характеристиках решений, их характеристиках и некоторых их свойствах.
Навыки для развития
- Определите эти термины: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Опишите различные типы решений.
- Различают ненасыщенные, насыщенные и перенасыщенные растворы.
Главный компонент раствора называется растворитель , а второстепенный компонент (ы) называется растворенным веществом . Если оба компонента в растворе составляют 50%, термин «растворенное вещество» может относиться к любому компоненту.Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называется растворенным веществом. Когда две жидкости растворяются друг в друге, основной компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
Многие химические реакции протекают в растворах, и растворы также тесно связаны с нашей повседневной жизнью. Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это решения.Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).
По теме решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы в зависимости от состояния раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, процент и доли), расчеты стехиометрии реакции с использованием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или обменные реакции: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение проблем стехиометрии раствора требует концепций, введенных в стехиометрию в главе 6, которая также обеспечивает основу для обсуждения реакций.
(Вернуться к началу)7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно рассматривать как единое вещество, хотя это не так. С другой стороны, гетерогенные смеси неоднородны и имеют участки смеси, которые отличаются от других участков смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид — это смесь, содержащая частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав во всем, но являются мутными или непрозрачными. Молоко — хороший пример коллоида. Истинные растворы имеют размер частиц типичного иона или небольшой молекулы (от 0,1 до 2 нм в диаметре) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно однородны и обычно представляют собой газо-газовые растворы . Для количественной обработки такого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, двуокиси углерода, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
- Когда молекулы газа, твердого вещества или жидкости диспергированы и смешаны с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы будем обсуждать, происходит в жидких растворах, в которых вода является растворителем.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают с образованием твердых растворов, называемых латунью.Серебро, золото и медь образуют множество различных сплавов, уникальных по цвету и внешнему виду. Сплавы и другие твердые растворы важны в мире химии материалов.
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах / 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором . Это означает, что к растворителю все еще может быть добавлено больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется в осадке в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор является насыщенным, если присутствует дополнительное растворенное вещество (оно может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система никоим образом не статична. Фактически растворенное вещество постоянно растворяется и откладывается с одинаковой скоростью. Такое явление называется равновесие . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы — это растворы, в которых растворенные вещества растворяются за пределами нормальной точки насыщения.Обычно для создания перенасыщенного раствора требуются такие условия, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако, когда к раствору добавляют кристалл затравки , дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию перенасыщенного раствора ацетата натрия. Видео: Школа естественных и математических наук Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одна из полезных классификаций материалов — полярность. Читая о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения имеют самую высокую полярность, образуя полные катионы и анионы внутри каждой молекулы, поскольку электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, разделяют ли атомы, участвующие в связи, электроны неравномерно или поровну, соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рисунок 7.1 Диаграмма разности электроотрицательностей. Приведенная выше диаграмма является руководством для определения типа связи между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются в соответствии с правилами ионного связывания.
Вещества с нулевой или низкой разностью электроотрицательности, такие как H 2 , O 2 , N 2 , CH 4 , CCl 4 , являются неполярными соединениями , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 выше разность электроотрицательностей — это полярных соединения .Обычно соединения, имеющие сходную полярность, растворимы друг в друге. Это можно описать правилом:
Подобно Растворяется Нравится.Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое растворенное вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Газообразные растворенные вещества уже отделены от составляющих частиц, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рисунке 7.2. Когда растворителем является вода, вместо сольватации используется слово гидратация .
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода — это высокополярный растворитель, способный растворять многие ионные соли. На рис. 7.2 показан процесс растворения, в котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частичным положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, что показано в виде молекулярной модели в (B) твердого тела. кристаллическая решетка хлорида натрия и (C) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в растворе в ионном состоянии. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере растворения и взаимодействия с молекулами воды. В случае ионных соединений, не растворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разрушены частичными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения обозначаются как электролиты . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия — пример сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, которые растворяются в отдельные нейтральные молекулы без диссоциации, не придают своим растворам дополнительную электропроводность и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любых важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl — . Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потерю электролитов после тяжелой тренировки.
Аналогичным образом решения могут быть получены путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом , , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два одинаковых раствора помещаются вместе и могут смешиваться в раствор, они считаются смешиваемыми . С другой стороны, жидкости, которые не имеют сходных характеристик и не могут смешиваться вместе, называются несмешивающимися .Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешивающимися .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при определении растворимости следует также учитывать эти другие факторы.
(Вернуться к началу)7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ соотношение температуры и растворимости не является простым или предсказуемым. На рис. 7.3 показаны графики растворимости некоторых органических и неорганических соединений в воде в зависимости от температуры. Хотя растворимость твердого вещества обычно увеличивается с повышением температуры, нет простой взаимосвязи между структурой вещества и температурной зависимостью его растворимости.Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) мало изменяются, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3. Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться с температурой; величина этой температурной зависимости широко варьируется между соединениями.
Изменение растворимости в зависимости от температуры было измерено для широкого диапазона соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80 ° C. а затем медленно охлаждают раствор до 0 ° C.Согласно температурным кривым на рисунке 7.3 оба соединения растворяются в воде при 80 ° C, и все 50 г KBr остаются в растворе при 0 ° C. Однако только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0 ° C, поэтому кристаллизуется примерно 114 г (150 г — 36 г) CH 3 CO 2 Na при охлаждении. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет нам восстановить около 75% исходного CH 3 CO 2 Na в практически чистой форме всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки таких разнообразных соединений, как показано на рис. 7.3, и от антибиотиков до ферментов. Чтобы методика работала должным образом, интересующее соединение должно быть более растворимым при высокой температуре, чем при низкой, чтобы понижение температуры заставляло его кристаллизоваться из раствора. Кроме того, примеси должны быть на более растворимыми на , чем представляющее интерес соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рисунке 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газовой форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Когда формируются эти новые силы притяжения, выделяется тепло. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Зависимость растворимости нескольких обычных газов в воде от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрочайнике, знает, что внутри накапливается белый или серый налет, который в конечном итоге необходимо удалить.То же явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных применений, где это называется «котельная накипь», — нагар, который может серьезно снизить пропускную способность труб горячего водоснабжения ( Рисунок 7.5). Проблема не только в современном мире: акведуки, построенные римлянами 2000 лет назад для транспортировки холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химический состав этих отложений умеренно сложен, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора.Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 — (бикарбонат). Бикарбонат кальция [Ca (HCO 3 ) 2 ] довольно растворим в воде, но карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием диоксида углерода, карбонат-иона и воды:
2HCO 3 — (вод.) → CO 2 2- (вод.) + H 2 O (л) + CO 2 (вод.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента котловой накипи.
Рисунок 7.5 Вес котла в водопроводе. Отложения карбоната кальция (CaCO 3 ) в трубах горячего водоснабжения могут значительно снизить пропускную способность труб. Эти отложения, называемые котловой накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В пункте тепловое загрязнение озерная или речная вода, которая используется для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, когда она попадала в растение. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания будет слишком низкой. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более холодной, плотной и более богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, если проблему не устранить, можно задохнуться даже в глубоких озерах. Кроме того, большинство рыб и других водных организмов, не являющихся млекопитающими, хладнокровны, а это означает, что температура их тела такая же, как температура окружающей среды. Температура, значительно превышающая нормальный диапазон, может привести к тяжелому стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любые неблагоприятные воздействия на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. Для этой популяции оптимальная температура воды составляет от 12,8 до 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищничеству и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите Focus Publication штата Вашингтон.
Похожий эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого является глобальное потепление. На каждые 1,5 ° C, которые нагревает вода в заливе, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, переместили свои популяции дальше на север.В 2005 году угорь, который является важным местом обитания рыб и моллюсков, исчез на большей части залива после рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтрующих элементов, что затем уменьшило светопропускание, что позволило угрям расти. Сложные взаимоотношения в экосистемах, таких как Чесапикский залив, особенно чувствительны к колебаниям температуры, вызывающим ухудшение качества среды обитания.
(Вернуться к началу)7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых тел. Напротив, растворимость газов увеличивается с увеличением парциального давления газа над раствором. Эта точка проиллюстрирована на рисунке 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с увеличением давления, концентрация молекул растворенного газа в растворе в состоянии равновесия также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается при увеличении парциального давления при постоянной температуре. (a) Когда газ входит в контакт с чистой жидкостью, некоторые молекулы газа (пурпурные сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась так, что скорость, с которой молекулы газа уходят в газовую фазу, была такой же, как скорость, с которой они растворяются, было установлено динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере того, как дополнительные молекулы газа растворяются при более высоком давлении, концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Взаимосвязь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кП
, где C — концентрация растворенного газа в состоянии равновесия, P — парциальное давление газа, а k — константа закона Генри , которая должна определяться экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами измерения постоянной закона Генри являются моль / (л · атм) = М / атм. Значения констант закона Генри для растворов нескольких газов в воде при 20 ° C приведены в таблице 7.2
Видеоурок по закону Генри от Академии Кана
Все материалы Khan Academy доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 демонстрируют, что концентрация растворенного газа в воде при заданном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ дисперсионные силы Лондона увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He до Ne и до Ar. Из таблицы также видно, что O 2 почти в два раза растворимее, чем N 2 . Хотя силы лондонской дисперсии слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным веществом и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно , оно очень слабо притягивается полюсами магнита, но не сохраняет никакого постоянного магнетизма).
Таблица 7.2 Константы закона Генри для выбранных газов в воде при 20 ° CПарциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C / k. Это важно во многих сферах жизни, включая медицину, где обычно измеряются газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать, используя следующее уравнение:
Где C 1 и P 1 — соответственно концентрация и парциальное давление газа в исходном состоянии, а C 2 и P 2 — концентрация и парциальное давление, соответственно, газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм? Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. На этом этапе проще всего будет изменить приведенное выше уравнение, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и решить для C 2 : Газы, которые химически реагируют с водой, такие как HCl и другие галогениды водорода, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водный) и Cl — (водный), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом газы, вступающие в реакцию с водой, не подчиняются закону Генри.
Закон Генри имеет важные приложения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит под CO 2 при давлении более 1 атм.При открытии бутылки давление CO 2 над раствором быстро падает, и часть растворенного газа улетучивается из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны и медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоком давлении под водой больше N 2 из воздуха растворяется во внутренних жидкостях дайвера. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование мелких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать кровоток по мелким кровеносным сосудам, вызывая сильную боль и в некоторых случаях даже смертельный исход.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низкие для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Чтобы увеличить концентрацию O 2 во внутренних жидкостях, организмы синтезируют хорошо растворимые молекулы-носители, которые обратимо связывают O 2 . Например, красные кровяные тельца человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи с целью получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37 ° C (нормальная температура тела) составляет всего 0,010 мМ, общая концентрация растворенного O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови, эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(Вернуться к началу)7,6 Твердые гидраты:
Некоторые ионные твердые вещества принимают небольшое количество молекул воды в свою кристаллическую решетку и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат молекулы воды, объединенные в определенном соотношении в качестве неотъемлемой части кристалла, которые либо связаны с металлическим центром, либо кристаллизовались с комплексом металла. Сообщается также, что такие гидраты содержат кристаллизационную воду или гидратную воду .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рис. 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллическая решетка (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлорида.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — количество молекул воды на формульную единицу соли. n обычно является низким целым числом, хотя возможны дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.В примере на рис. 7.7 гидратированный хлорид кобальта будет обозначен: «хлорид кобальта (II) 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi — 1/2
- моно — 1
- Сескви — 1½
- Ди — 2
- Три — 3
- Тетра — 4
- Пента — 5
- Hexa — 6
- Гепта — 7
- Окта — 8
- Нона — 9
- Дека — 10
- Undeca — 11
- Додека — 12
Гидрат, потерявший воду, называют ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании.Вещество, не содержащее воды, обозначается как безводное . Некоторые безводные соединения настолько легко гидратируются, что вытягивают воду из атмосферы и становятся гидратированными. Эти вещества называются гигроскопичными и могут использоваться как осушители или осушители .
(Вернуться к началу)7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.Все мы качественно представляем, что подразумевается под концентрацией . Любой, кто варил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматный и высококонцентрированный напиток, а слишком маленькое — разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в определенном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество разных способов определения концентраций. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей на раствор.
Наиболее распространенной единицей концентрации является молярность , что также является наиболее полезным для расчетов, включающих стехиометрию реакций в растворе. Молярность раствора (M) — это количество молей растворенного вещества, присутствующего точно в 1 л раствора.
Таким образом, единицами молярности являются моль на литр раствора (моль / л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, который содержит 1 моль (342 г) сахарозы в достаточном количестве воды, чтобы получить конечный объем 1,00 л, имеет концентрацию сахарозы 1,00 моль / л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак
[сахароза] = 1,00 M
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 M NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0.100 моль / л (Примечание: при вычислении задач всегда записывайте единицы молярности как моль / л, а не M. Это позволит вам отменить единицы при выполнении вычислений.)
Запрошено: Количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти желаемую единицу, в данном случае молей. (2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают. Выполните все необходимые преобразования, чтобы единицы совпадали. (3) Введите значения соответствующим образом и выполните математические вычисления.
Решение:
(1) Перепишите приведенное выше уравнение, чтобы найти количество молей.
(2) Еще раз проверьте все единицы в уравнении и убедитесь, что они совпадают.
Приведенные значения для этого уравнения: объем 2,50 л и молярность 0,100 моль / л. Единицы объема для обоих этих чисел указаны в литрах (L) и, следовательно, совпадают. Следовательно, никаких преобразований производить не нужно.
(3) Введите значения соответствующим образом и выполните математические вычисления.
Приготовление растворовОбратите внимание, что в приведенном выше примере у нас все еще недостаточно информации, чтобы фактически приготовить раствор в лаборатории. Не существует оборудования, которое могло бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы для взвешивания количества вещества, необходимого для приготовления раствора.В приведенном выше примере:
Чтобы фактически приготовить раствор, обычно растворяют растворенное вещество в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, конечный объем может быть доведен до 2,50 л. Если вы добавляете 10 г NaOH напрямую до 2,50 л конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рисунке 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта (II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя на меньше, чем на требуемый общий объем раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого вещества. Чтобы приготовить раствор, сначала добавьте в колбу часть растворителя. Затем взвесьте необходимое количество растворенного вещества и медленно добавьте его к растворителю.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горловине колбы. В данном случае это 500 мл раствора. Мерные колбы бывают разных размеров, чтобы вместить разные объемы раствора. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая химические стаканы и колбы Эрленмейера, недостаточно точна для большинства решений.
Пример расчета молярности
Раствор на рисунке 7.8 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна
моль / литр.2. Чтобы вычислить молярность, нам нужно выразить:
- масса в виде молей
- объем в литрах
- Подставьте оба в уравнение выше и вычислите
Решение:
- Преобразование массы в моль. Мы можем использовать молярную массу для перевода граммов CoCl 2 · 2H 2 O в моль.
- Молярная масса CoCl 2 · 2H 2 O составляет 165.87 г / моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Перевести объем в литры
3. Подставьте значения в уравнение полярности:
7.7.2 Количество частей в решенияхВ потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или и в том, и в другом (т. Е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m / м), (об / об) и (м / об).
В большинстве прикладных областей химии часто используется мера (м / м), тогда как в клинической химии обычно используется (м / об) с массой , выраженной в граммах и объемом в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », которые все мы знаем как « процентов ».« Cent » — это префикс латинского происхождения, относящийся к числу 100
(L. centum ), как в столетии или столетии . Он также обозначает 1/100 (от L. centesimus ), как сантиметр и денежную единицу цент . Процентные растворы определяют количество растворенного вещества, которое растворено в количестве раствора, умноженном на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м / м%) или массы растворенного вещества на объем раствора (м / об.%) или объем растворенного вещества на объем раствора (об. / об.%).При создании процентного раствора важно указать, какие единицы измерения используются, чтобы другие также могли правильно принять решение. Также помните, что раствор представляет собой сумму как растворителя, так и растворенного вещества, когда вы выполняете расчет процентов.
Раствор = Раствор + Растворитель
Таким образом, при вычислении процентных решений можно использовать следующее уравнение:
Пример 1:В качестве примера, раствор этанола в воде с концентрацией 7,0% об. / Об. Должен содержать 7 мл этанола в общем количестве 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = Раствор + Растворитель
Таким образом, мы можем ввести значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив 7 на другую сторону, мы увидим, что:
100 мл — 7 мл = 93 мл H 2 O
Пример 2Какое (м / об)% раствора, если 24.0 г сахарозы растворяют в общем растворе 243 мл?
Пример 3Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для обозначения количества следов загрязняющих веществ в окружающей среде.
Одинаковые процентные («части на сотню») единицы, ppm и ppb могут быть определены в единицах массы, объема или смешанных единиц массы-объема.Также существуют единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения ppm и ppb приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентраций загрязняющих веществ и других микропримесей в воде. Концентрации этих загрязнителей, как правило, очень низкие в очищенных и природных водах, и их уровни не могут превышать относительно низкие пороговые значения концентрации, не вызывая неблагоприятных последствий для здоровья и дикой природы.Например, EPA определило, что максимально безопасный уровень фторид-иона в водопроводной воде составляет 4 ppm. Встроенные фильтры для воды предназначены для снижения концентрации фторида и некоторых других незначительных примесей в водопроводной воде (рис. 7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду небезопасной для питья и приготовления пищи. (б) Встроенные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит А: модификация работы Дженн Дарфи; кредит б: модификация работы «Вастатепаркстафф» / Wikimedia commons
При сообщении о загрязнителях, таких как свинец, в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы / объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не массы. Кроме того, плотность воды составляет 1,0 г / мл или 1,0 мг / 0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 ppm, это будет означать, что есть:
Концентрации растворенных ионов иногда выражаются в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 моль положительного или отрицательного заряда. Таким образом, 1 моль / л Na + (водн.) Также равно 1 экв / л, потому что натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) С концентрацией 1 моль / л имеет концентрацию 2 экв / л, потому что кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв.) — например, общая концентрация плазмы крови человека составляет около 150 мэкв / л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- реагировать или поставлять один моль ионов водорода (H + ) в кислотно-основной реакции
- реагируют или поставляют один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалент — это количество молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв. Na, 2 экв. Ca и 3 экв. Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Вернуться к началу)7,8 Разведения
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации.Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор желаемой концентрации можно также приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем.Для этой цели часто используется основной раствор, который представляет собой приготовленный раствор известной концентрации. Разбавление основного раствора предпочтительнее при приготовлении растворов с очень слабой концентрацией, потому что альтернативный метод, взвешивание крошечных количеств растворенного вещества, может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 7.10. Это требует расчета желаемого количества растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества. Помните, что при разбавлении данного количества исходного раствора растворителем , а не , изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора может быть математически выражено как:
Где M s — концентрация основного раствора, V s — объем основного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рисунок 7.10 Приготовление раствора известной концентрации путем разбавления исходного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряют из исходного раствора известной концентрации. (b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: Объем и молярность разбавленного раствора и молярность основного раствора
Запрошено: объем основного раствора
Стратегия и решение:
Для задач разбавления, если вам известны 3 переменные, вы можете решить для 4-й переменной.
- Начните с перестановки уравнения, чтобы найти переменную, которую вы хотите найти. В этом случае вы хотите найти объем основного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для проведения расчетов они должны быть в одной и той же единице (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был дан в молярности, а другой в процентах, или один был в молярности, а другой был в миллимолярности, один из терминов нужно было бы преобразовать, чтобы они совпадали.Таким образом, единицы будут отменены, и в этом случае вы останетесь с единицами громкости.
3. Наконец, заполните уравнение с известными значениями и вычислите окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимое для окончательного разбавления. (Общий объем — объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл — 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе) .
7,9 Концентрации ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего растворенного вещества, деленного на объем раствора. Давайте более подробно рассмотрим, что это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они переходят в ионное состояние.Катионы и анионы связываются с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, дихромат аммония (NH 4 ) 2 Cr 2 O 7 представляет собой ионное соединение, которое содержит два иона NH 4 + и один Cr 2 O 7 2− ионов на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2-.Если мы рассмотрим это решение математически, мы увидим, что для каждой молекулы дихромата аммония, которая растворяется, образуются три результирующих иона (два иона NH 4 + и один Cr 2 O 7 2- ион). Это также можно представить в более крупном молярном масштабе. Когда 1 моль (NH 4 ) 2 Cr 2 O 7 растворяется, образуется 3 моля ионов (1 моль Cr 2 O 7 2- анионов и 2 моль катионов NH 4 + ) в растворе (рисунок 7.11). Чтобы обсудить взаимосвязь между концентрацией раствора и результирующим количеством ионов, используется термин эквиваленты .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. Растворение 1 моля формульных единиц дихромата аммония в воде дает 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + . (Молекулы воды не показаны с молекулярной точки зрения для ясности.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1.43 M, потому что на формульную единицу приходится один ион Cr 2 O 7 2-. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 производит трех ионов при растворении в воде (2NH 4 + + 1Cr 2 O 7 2-), всего концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно затем рассчитать, разделив 1,43 M на 4,29 M, получив 0,333 эквивалента. Таким образом, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M дюйм (NO 3 ) 3
Дано: Молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит.
B Если соединение неэлектролит, его концентрация такая же, как молярность раствора. Если соединение является сильным электролитом, определите количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия — это ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21
2. 3,7 M (CH 3 ) CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 м
3. 0,032 M дюйм (NO 3 ) 3
A Нитрат индия представляет собой ионное соединение, которое содержит ионы In 3+ и ионы NO 3 —, поэтому мы ожидаем, что он будет вести себя как сильный электролит в водном растворе
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3+ и три иона NO 3 —, так что 0,032 M In (NO 3 ) 3 раствор содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3+ ] = 0,032 M и [NO 3 — ] = 0,096 M
(Вернуться к началу)7.10 Внимание к окружающей среде: загрязнение свинцом История использования свинца в США
В главе 5 вы познакомились с EPA и с тем, как параметры качества воздуха отслеживаются для определения уровней загрязнения.Одним из шести основных параметров, за которым ведется мониторинг в соответствии с Законом о чистом воздухе, является свинец. Свинец естественным образом встречается в земной коре в очень низких концентрациях, ~ 0,001%, и выглядит как сине-серый металл, мягкий и плотный. Он широко используется в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве материала для пайки труб и керамики, хрусталя и других известных коммерческих продуктов. Особенно часто свинец использовался в красках для наружных работ и в качестве добавки к бензину (рис.7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему является проблематичным и вызывает повышенный риск для здоровья населения.
Рисунок 7.12 История использования свинца в красках и бензине на протяжении большей части 20 века. На графике показано раннее преобладание свинцовых красок, за которым последовал бум в транспортировке, что привело к высокому использованию этилированного бензина.Спад после середины 1970-х годов был связан с контролем, введенным EPA для исключения этилированного бензина. Источник: Filippelli и др. (2005) использовано с разрешения.
Национальные стандарты качества окружающего воздуха (NAAQS) для свинца установлены на уровне 0,15 микрограмма на кубический метр Pb в общем количестве взвешенных частиц в среднем за 3 месяца. Как видно из рисунка 7.13, уровни свинца в атмосфере были очень высокими до середины 1990-х годов, после чего мы наблюдали резкое падение уровней свинца в атмосфере.Этот всплеск содержания свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано отрицательное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин вступил в силу в 1996 году.
Рис. 7.13 Уровни содержания свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха по участкам тренда, отображая средние 80%.Белая линия представляет собой среднее значение по всем сайтам трендов. Девяносто процентов участков имеют концентрации ниже верхней черты, в то время как десять процентов площадок имеют концентрации ниже нижней черты. (B) Максимальный годовой максимальный трехмесячный средний уровень содержания свинца в атмосфере, демонстрирующий снижение уровня загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA
Использование тетраэтилсвинца (TEL) было определено General Motors в качестве присадки к топливу, повышающей общее октановое число бензина.Это позволило значительно повысить компрессию двигателя, что привело к увеличению производительности автомобиля и большей экономии топлива.
TEL получают реакцией хлорэтана с натрием — свинцом сплавом
4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb
Продукт регенерируется путем перегонки с водяным паром, в результате чего остается ил из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, который включает металлический натрий и превращает только 25% свинца в TEL. ТЕЛ — вязкая бесцветная жидкость. Поскольку TEL является нейтральным по заряду и содержит внешние углеродные группы, он очень липофильный, (жиролюбивый) и растворим в бензине.
При сжигании этилированного бензина выделяется не только диоксид углерода и вода, но и свинец
(CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb
Образующийся свинец также может окисляться при сгорании с образованием оксида свинца (II)
2 Pb + O 2 → 2 PbO
Образование Pb и PbO внутри автомобильного двигателя быстро накапливается в избытке и вызывает серьезные повреждения двигателя.Таким образом, молекулы, улавливающие свинец, также должны были быть добавлены в бензин для реакции с продуктами свинца, образующимися во время сгорания. Обычно для этого процесса использовались 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучий бромид свинца (II) и хлорид свинца (II), которые затем могут выбрасываться в атмосферу из двигателя.
Повышенные уровни свинца в атмосфере, вызванные использованием автомобилей, сильно коррелировали с повышенными уровнями свинца в крови среди населения.
7.14 Снижение среднего уровня свинца в крови у детей в США и общего количества свинца, использованного в год в бензине в 1974-1992 годах (адаптировано из U.S.EPA 1999).
Биологические эффекты свинца
После того, как свинец попадает в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Проведенное в Цинциннати исследование продемонстрировало, что воздействие свинца в детстве вызывает потерю серого вещества в головном мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (Рисунок 7.15).
Рис. 7.15. Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, подвергшихся воздействию свинца в детстве, показывает уменьшенный объем, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Cecil, KM, et al.
Острое воздействие свинца может вызвать отравление свинцом и привести к болям в животе, запорам, головным болям, раздражительности, проблемам с памятью, неспособности иметь детей и покалыванию в руках и ногах.Это вызывает почти 10% умственной отсталости по другой неизвестной причине и может привести к поведенческим проблемам. Некоторые эффекты постоянны. В тяжелых случаях может наступить анемия, судороги, кома или смерть.
Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или потребительские товары. Дети подвергаются большему риску, так как они чаще кладут в рот предметы, например, содержащие свинцовую краску и поглощающие большую часть свинца. что они едят. Воздействие свинца на работе — частая причина отравления свинцом у взрослых людей определенных профессий, которым грозит особый риск.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг / дл (10 мкг / 100 г) и для детей на уровне 5 мкг / дл.
Интересная корреляция: преступность и уровни свинца в кровиРяд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем свинца в крови дошкольников и последующим уровнем преступности, особенно насильственных преступлений, произошедших 20 лет спустя (Рисунок 7.16).
Рис. 7.16. Соотношение уровней содержания свинца в крови в дошкольном возрасте и насильственных преступлений, совершенных 23 года спустя.
В начале 1990-х годов убийства и насильственные преступления достигли рекордного уровня, которому не видно конца. Однако к концу 1990-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого спада, включая увеличение количества заключенных и увеличение количества полицейских.Однако уровни свинца в крови показывают очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, в том числе на хомяках и кошках, показали, что воздействие свинца увеличивает или усиливает агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные уровни тюремного заключения и охраны правопорядка, показывают аналогичные тенденции в насильственных преступлениях с уровнями содержания свинца в крови у детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате употребления этилированного бензина объясняет, по крайней мере частично, рост уровня насильственной преступности в 1980-х и начале 1990-х годов в Соединенных Штатах.
Текущие проблемы и опасенияНесмотря на то, что за последние 40-50 лет использование свинца резко сократилось, он все еще может быть обнаружен в повышенных концентрациях в почвах, особенно в городских и промышленных районах.Кроме того, свинец ранее использовался для строительства водопроводных труб, поскольку он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в стыках и соединениях которых использовалась свинцовая пайка. В апреле 2014 года это стало серьезной проблемой для жителей Флинта, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для обеспечения питьевой водой этого района.Экономия затрат оценивалась примерно в 10 миллионов долларов в год. Однако на строительство трубопровода потребуется несколько лет. Таким образом, чтобы сразу же сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт на время завершения строительства нового трубопровода. Однако с речной водой может быть труднее справиться из-за более сильных колебаний в остатках стока, и почти сразу жители Флинта, штат Мичиган, начали жаловаться на неприятный запах, неконтролируемую воду, идущую из кранов (рис.7.17).
Рисунок 7.17. Ли-Энн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. al. (2017).
Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, из-за чего Флинт, штат Мичиган, выпустил рекомендации по кипячению и увеличил количество хлора, используемого для обработки воды. Это, в свою очередь, увеличивало производство тригалометанов. Тригалометаны образуются в результате реакции хлорсодержащих дезинфицирующих средств в воде с присутствующими органическими веществами, такими как те, которые образуются водорослями, присутствующими в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и привкус воды. Они также опасны при вдыхании, делая душ в горячей загрязненной воде серьезным риском для здоровья.
Таким образом, в попытке уменьшить образование побочных продуктов тригалогенметана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды.Однако они не смогли добавить никаких молекул, контролирующих коррозию, таких как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимого фосфата свинца, который не проникает в водопровод (рис. 7.18). Отсутствие контроля над коррозией со стороны города Флинт в сочетании с повышенным количеством FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl — . Результатом было общее увеличение потенциала коррозии, измеренное по массовому отношению хлорида к сульфату, от 0.45 для системы водоснабжения Детройта до 1,60 для новой системы водоснабжения реки Флинт. Имея такой потенциал коррозии, молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца выделялись окисленные формы железа, вызывающие большее обесцвечивание воды.
Рис. 7.18. Процесс коррозии во время водного кризиса во Флинте, штат Мичиган.
Чтобы получить интерактивную анимацию этого химического процесса, посмотрите этот
Видео журнала Scientific American — Коррозионная химия: как свинец попал в питьевую воду Флинта
Из-за протеста общественности и отказа города Флинта принимать меры в связи с плохим качеством воды компания Virgina Tech начала программу тестирования воды и обнаружила чрезвычайно высокие уровни свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно было бы употреблять, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самый высокий образец, зарегистрированный Технологическим институтом штата Вирджиния, составил 13 000 частей на миллиард из образца в доме Ли-Энн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей, находящихся в этом районе, превышающий установленные CDC предельные уровни в крови, за это время увеличился вдвое (рис. 7.19). Несколько ожидающих рассмотрения судебных исков в настоящее время находятся в стадии рассмотрения из-за халатности города Флинт и органов, регулирующих качество воды в регионе.
Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после переключения на источник воды реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, проверено выше пределов безопасности EPA для свинца после перехода на источник воды в реке Флинт. Нижняя панель показывает уровни свинца в крови у детей, регулярно проверяемые на уровни свинца в крови в районе как до, так и после перехода на новый источник воды. Источник: Flint Water Study
.Предлагаемое задание: Учителя могут загрузить основанное на обсуждении задание на тему «Экологическая несправедливость и влияние токсичного загрязнения воды во Флинте, штат Мичиган,
».Flint Water Crisis Environmental Justice Assignment
7.11 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует проанализировать значения терминов, выделенных жирным шрифтом в следующем резюме, и спросить себя, как они соотносятся с темами в главе.
Раствор представляет собой однородную смесь. Основным компонентом является растворитель , а второстепенным компонентом — растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворимые вещества — это растворимые или нерастворимые , что означает, что они растворяются или не растворяются в конкретном растворителе. Термины смешивающийся, и несмешивающийся, вместо «растворимый и нерастворимый» используются для жидких растворенных веществ и растворителей. Утверждение « подобно растворяется как » является полезным руководством для прогнозирования того, будет ли растворенное вещество растворяться в данном растворителе.
Растворение происходит путем сольватации , процесса, в котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их с образованием раствора.Для водных растворов используется слово гидратация . Если растворенное вещество является молекулярным, оно растворяется на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, который проводит электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое будет растворяться в данном количестве растворителя, называется растворимостью растворенного вещества . Такими решениями являются насыщенные . Растворы, у которых количество меньше максимального, — это ненасыщенные . Большинство растворов являются ненасыщенными, и их концентрацию можно указать разными способами. Массовый / массовый процент , объем / объемный процент и массовый / объемный процент указывают процент растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является стандартной единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в молях заряда на ионах. Когда раствор разбавляется, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы можно было определить объем или концентрацию конечного разбавленного раствора.Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- Канал 3 Канал 2 Канал 2 ОН
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Можно ли ожидать, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
a) Nh4 — слабое основание, что означает, что некоторые молекулы будут принимать протон от молекул воды, заставляя их диссоциировать на ионы H + и -OH.Ион H + будет ассоциироваться с Nh4 с образованием Nh5 +. Таким образом, это будет больше всего похоже на стакан №2. б) HF — слабая кислота, хотя F сильно электроотрицателен. Это связано с тем, что молекула H-F может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O + и F-. c) CH 3 CH 2 CH 2 OH является ковалентным соединением и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.г) Na 2 SO 4 — это растворимое ионное соединение, которое полностью диссоциирует на ионы, больше всего похоже на химический стакан № 1.
Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl —), тогда как NaCl будет диссоциировать только на 2 иона (Na + и Cl —) для каждой молекулы. Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучше проводить электричество.
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,1065 млн бай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1.40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Моль Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием исходного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья. Если раствор имеет концентрацию Ca (OCl) 2 , равную 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке определенного лекарства есть инструкция по добавлению 10.0 мл стерильной воды, заявив, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответов
а. 39,13 г б. 161,0 г c. 93,57 г г. 201,8 г
а. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, c. 150 мл 0,769 М раствора
а.0.815 М, г. 2.09 М, c. 0.182 М, д. 0,684 M
а. 0.174 М, г. 0.297 М, c. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 M, Na 2 SO 4 = 0,563 M, б. Ca (OH) 2 = 1.08 M, h4PO4 = 0.816 M, c. Al (NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, д. Pb (NO 3 ) 2 = 0,242 M, CuSO 4 = 0,501 M, т.е. Al (CH 3 CO 2 ) = 0.392 M, NaOH = 2,00 M
1,74 × 10 −3 M кофеин
7.12 Ссылки
- Чанг (Питер) Чие (2016) Неорганическая химия. Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
- Болл, Д.У., Хилл, Дж. У. и Скотт, Р. Дж. (2016) MAP: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Принципы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедия, Бесплатная энциклопедия . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169 .
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.html
- Мичиганская сеть по охране окружающей среды детей (2013 г.) Здоровье окружающей среды детей в Мичигане.Вики по гигиене окружающей среды. Проверено 6 сентября 2018 г. по адресу: http://wiki.mnceh.org/index.php/Neurotoxicity:_Lead .
- участников Википедии. (2018, 5 сентября). Отравление свинцом. В Википедия, Бесплатная энциклопедия . Получено в 02:05, 7 сентября 2018 г., с https://en.wikipedia.org/w/index.php?title=Lead_poisoning&oldid=858177302 .
- Ladapo, J.A., Mohammed, A.K., and Nwosu, V.C. (2017) Загрязнение свинцом во Флинте, Мичиган, США и других городах. Международный журнал экологического и научного образования, 11 (5): 1341-1351.Открытый доступ. Доступно по адресу: www.ijese.net/makale_indir/1899
Разведений и концентраций — Вводная химия — 1-е канадское издание
Цель обучения
1. Узнайте, как разбавлять и концентрировать растворы.
Часто рабочему необходимо изменить концентрацию раствора, изменив количество растворителя. Разбавление — это добавление растворителя, которое снижает концентрацию растворенного вещества в растворе. Концентрация — это удаление растворителя, которое увеличивает концентрацию растворенного вещества в растворе.(Не путайте здесь два значения слова концентрация !)
И при разбавлении, и при концентрации количество растворенного вещества остается неизменным. Это дает нам возможность рассчитать, каким должен быть новый объем раствора для желаемой концентрации растворенного вещества. Из определения молярности,
молярность = моль растворенного вещества / литр раствора
мы можем найти количество молей растворенного вещества:
моль растворенного вещества = (молярность) (литры раствора)
Более простой способ записать это — использовать M для представления молярности и V для представления объема.Таким образом, уравнение становится
моль растворенного вещества = MV
Поскольку это количество не меняется до и после изменения концентрации, продукт MV должен быть одинаковым до и после изменения концентрации. Используя числа для обозначения начальных и конечных условий, получаем
M 1 V 1 = M 2 V 2
как уравнение разбавления.Объемы должны быть выражены в одинаковых единицах. Обратите внимание, что это уравнение дает только начальные и конечные условия, а не величину изменения. Сумма изменения определяется вычитанием.
Пример 9
Если 25,0 мл 2,19 М раствора разбавить до 72,8 мл, какова конечная концентрация?
Решение
Не имеет значения, какой набор условий помечен как 1 или 2, если условия правильно спарены вместе. Используя уравнение разбавления, получаем
(2.19 M) (25,0 мл) = M 2 (72,8 мл)
Решение для второй концентрации (с учетом того, что единицы миллилитры отменяют),
M 2 = 0,752 M
Концентрация раствора уменьшилась. При переходе от 25,0 мл до 72,8 мл необходимо добавить 72,8–25,0 = 47,8 мл растворителя.
Проверьте себя
В 0,885 М раствор KBr, начальный объем которого составляет 76,5 мл, добавляют еще воды до тех пор, пока его концентрация не станет равной 0.500 М. Какой новый объем раствора?
Ответ
135,4 мл
Концентрирование растворов включает удаление растворителя. Обычно это делается путем испарения или кипячения, предполагая, что теплота кипения не влияет на растворенное вещество. Уравнение разбавления также используется в этих обстоятельствах.
Химия везде: подготовка растворов для внутривенного вливания
В отделении неотложной помощи больницы врач назначает внутривенное (IV) введение 100 мл 0.5% KCl для пациента, страдающего гипокалиемией (низким уровнем калия). Бежит ли помощник к шкафу с припасами и вынимает ли ему пакет для внутривенных вливаний с такой концентрацией KCl?
Вряд ли. Более вероятно, что помощник должен приготовить подходящий раствор из мешка для внутривенного введения стерильного раствора и более концентрированного стерильного раствора, называемого маточным раствором KCl. Ожидается, что помощник будет использовать шприц, чтобы набрать немного исходного раствора, ввести его в ожидающий пакет для внутривенных вливаний и разбавить до нужной концентрации.Таким образом, помощник должен выполнить расчет разбавления.
Медицинский персонал обычно должен выполнять разведения для внутривенных растворов. Источник: «Infuuszakjes» Хармида находится в открытом доступе.Если исходный раствор представляет собой 10,0% KCl, а конечный объем и концентрация должны составлять 100 мл и 0,50% соответственно, то определить, какое количество исходного раствора следует использовать, несложно:
(10%) V 1 = (0,50%) (100 мл)
V 1 = 5 мл
Конечно, добавление основного раствора влияет на общий объем разбавленного раствора, но конечная концентрация, вероятно, достаточно близка даже для медицинских целей.
Медицинский и фармацевтический персонал постоянно работает с дозировками, требующими измерения концентрации и разведения. Это важная ответственность: неправильный расчет дозы может оказаться бесполезным, вредным или даже смертельным!
Основные выводы
- Рассчитайте новую концентрацию или объем для разведения или концентрации раствора.
Упражнения
В чем разница между разбавлением и концентрацией?
Какое количество остается постоянным при разбавлении раствора?
А 1.88 М раствор NaCl имеет начальный объем 34,5 мл. Какова конечная концентрация раствора, если его развести до 134 мл?
0,664 М раствор NaCl имеет начальный объем 2,55 л. Какова конечная концентрация раствора, если его разбавить до 3,88 л?
Если необходимо разбавить 1,00 мл раствора 2,25 M H 2 SO 4 до 1,00 M, каков будет его конечный объем?
Если 12,00 л из 6.00 M HNO 3 Раствор необходимо развести до 0,750 M, каков будет его конечный объем?
Если 665 мл 0,875 M раствора KBr осторожно кипятить для концентрирования растворенного вещества до 1,45 M, каков будет его конечный объем?
Если 1,00 л раствора LiOH довести до 164 мл и его начальная концентрация составляет 0,00555 М, какова его конечная концентрация?
Сколько воды необходимо добавить к 75,0 мл 0,332 М FeCl 3 (водн.), Чтобы снизить его концентрацию до 0.250 М?
Сколько воды необходимо добавить к 1,55 л 1,65 M Sc (NO 3 ) 3 (водн.), Чтобы снизить его концентрацию до 1,00 M?
ответы
1.
Разбавление — это уменьшение концентрации раствора, тогда как концентрация — это увеличение концентрации раствора.
3.
0,484 M
5.
2,25 мл
7.
401 мл
9.
24,6 мл
Как рассчитать молярную концентрацию раствора | FAQ
Единица молярной концентрации [моль / л (М)] традиционно широко используется в качестве метода концентрации. Это количество молей целевого вещества (растворенного вещества), растворенных в 1 литре раствора. Вот как рассчитать концентрацию.
(вес 1 литра раствора) x (чистота) ÷ молекулярная масса
[удельный вес раствора (г / мл) x 1000 (мл) x чистота (вес / вес%) / 100 ÷ молекулярный вес]
Например, рассчитаем молярную концентрацию 2-меркаптоэтанола (HSCH 2 CH 2 OH).Необходимая информация следующая.
- Удельный вес (или плотность) = 1,114 г / мл
- Чистота (или содержание) = 100 мас.% (Предполагается)
- Молекулярный вес = 78,13
Рассчитав это значение, применив это значение к приведенному выше уравнению, вы можете узнать молярную концентрацию.
1,114 г / мл x 1000 мл x 100 мас.% / 100 ÷ 78,13 = 14,26 моль / л
Чтобы рассчитать концентрацию, как указано выше, необходимо знать три точки: «удельный вес (или плотность)», «чистоту (или содержание)» и «молекулярный вес».Приведенная ниже таблица представляет собой краткую справочную таблицу общих концентраций кислоты и основания. В кислотах и щелочах используется «нейтрализационное титрование», часто используется «нормальность (N)».
【Краткая справочная таблица общих концентраций кислоты и основания】
| Соединение | Молекулярная формула | Молекулярный вес | Purity (w / w %) | Удельный вес (20 ℃) | Концентрация (моль / л) | эквивалент | Нормальность (N) |
|---|---|---|---|---|---|---|---|
| Соляная кислота | HCl | 36.46 | 20% | 1,10 | 6,0 | 1 | 6,0 |
| 35% | 1,17 | 11,2 | 11,2 | ||||
| Азотная кислота | ГНО 3 | 63.01 | 60% | 1,37 | 13,0 | 1 | 13,0 |
| 65% | 1,39 | 14,3 | 14,3 | ||||
| 70% | 1.41 | 15,7 | 15,7 | ||||
| Сульфат | H 2 SO 4 | 98,08 | 100% | 1,83 | 18,7 | 2 | 37,3 |
| Фосфорная кислота | H 3 PO 4 | 98,00 | 85% | 1,69 | 14,7 | 3 | 44,0 |
| 90% | 1,75 | 16.1 | 48,2 | ||||
| Ацетат | CH 3 COOH | 60,05 | 100% | 1,05 | 17,5 | 1 | 17,5 |
| Хлорная кислота | HClO 4 | 100,46 | 60% | 1,54 | 9,2 | 1 | 9,2 |
| 70% | 1,67 | 11,6 | 11,6 | ||||
| Вода с перекисью водорода | H 2 O 2 | 34.01 | 30% | 1,11 | 9,8 | – | |
| 35% | 1,13 | 11,6 | |||||
| Аммиачная вода | NH 3 | 17,03 | 25% | 0,91 | 13,4 | 1 | 13,4 |
| 28% | 0,90 | 14,8 | 14,8 | ||||
【Краткий справочник по концентрации и единицам измерения】
● Как выразить концентрацию раствора
| Выражение | Комментарий |
|---|---|
| Массовая процентная концентрация | «г» растворенного вещества в 100 г. раствора.Во многих случаях выражается как мас.%, Мас.% И% для плотности. |
| Объемная процентная концентрация | мкм растворенного вещества в 100м растворе. Выражается как об. / Об., Если смесь или растворенное вещество являются жидкими. |
| Вес в зависимости от концентрации в процентах от объема | г количество растворенного вещества в 100 мл раствора. Выражается в% мас. / Об. |
| Нормальность | Грамм эквивалентное количество растворенного вещества в 1 л раствора. Выражается как N для анализа емкости. |
| Объемная удельная концентрация | Концентрация косвенно выражается объемным соотношением разбавленного жидкого реагента. Он используется в JIS и других. Пример: Серная кислота (1 + 2) → Серная кислота показана разбавленной 2 объемами воды. |
| Массовая доля концентрации | Концентрация, косвенно выраженная через массовое соотношение, при котором растворяется твердый реагент. Он используется в JIS и других. Пример: хлорид натрия (1 + 19) → Растворено в 19 вес. Воды по отношению к 1 NaCl. |
| Молярность | Моль количество целевого вещества (растворенного вещества) в 1 л раствора. Выражается как моль / или М. |
● Префикс, представляющий несколько
| Экспресс | Экспресс малогабаритность | |||
|---|---|---|---|---|
| 100 = 10 2 | часов (Hecto) | 1/100 = 10 -2 | c (Centi) | % (Percent) |
| 1000 = 10 3 | k (килограмм) | 1/1000 = 10 -3 | м (Милли) | ‰ (Permili) |
| 100 万 = 10 6 | M (Mega) | 1/100 万 = 10 -6 | мкм (Micro) | частей на миллион |
| 1 миллиард = 10 9 | Гб (Гига) | 1/10 миллиарда = 10 -9 | n (Nano) | частей на миллиард |
| 1 триллион = 10 12 | T (Tera) | 1/1 триллиона = 10 -12 | p (Pico) | п. |


 В общих случаях используется портландцемент марок 400 и 500 без минеральных добавок или с минеральными добавками в количестве до 20%. Для особых эксплуатационных условий применяют сульфатостойкое, гидротехническое, пластифицированное цементное вяжущее.
В общих случаях используется портландцемент марок 400 и 500 без минеральных добавок или с минеральными добавками в количестве до 20%. Для особых эксплуатационных условий применяют сульфатостойкое, гидротехническое, пластифицированное цементное вяжущее.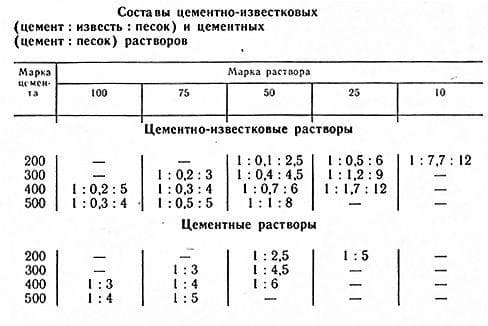
 Примерное количество воды – половина от объема цемента.
Примерное количество воды – половина от объема цемента.