СВ 95-3 IV (шифр 20.0139) по стандарту: Шифр 20.0139
Стойка СВ 95-3 IV (шифр 20.0139) — это вытянутое прямоугольное железобетонное изделие из тяжелого плотного бетона, дополнительно упрочненное арматурным каркасом. Простота конструкции, отличные прочностные характеристики и длительный срок эксплуатации являются основными преимуществами таких изделий. Данный строительный элемент предназначен для монтажа опор промежуточного и анкерного углового типа с целью подвески проводов ВЛ 0.4 кВ. Запроектированная по регламенту Шифр 20.0139 стойка, имеет такую отличительную особенность, как наличие вывода контактов, для присоединения к ним переносных заземлений, с целью увеличения безопасности при ремонте ВЛ. СВ 95-3 IV (шифр 20.0139) предполагается для применения в любых средах, в районах I-VII по ветру и в I-IV по гололеду.
Расшифровка маркировки изделия
Всем железобетонным стойкам присваивается определенная маркировка.
1. СВ — стойка вибрированная;
2. 95 — длина в дециметрах;
3. 3 — нагрузка;
4. IV — класс используемой арматуры.
Маркировочные символы наносятся на внешней поверхности готового изделия с помощью штампов или окраской по трафарету. Применяемая здесь краска должна быть темного оттенка, стойкая к различным воздействиям окружающей среды.
Материалы и производство
Железобетонные вибрированные стойки изготавливают в заводских условиях, в металлических формах, на основании регламента Шифр 20. 0139. В качестве основы при производстве стойки СВ 95-3 IV (шифр 20.0139) используется тяжелый бетон класса на сжатие В30, который изготавливается из сульфатостойкого цемента или портландцемента. Марка бетонной смеси по морозостойкости — не менее F200, по водонепроницаемости — W6. Передаточная прочность бетона должна составлять не менее 80% при положительной температуре наружного воздуха и не менее 90% при отрицательной температуре наружного воздуха.
0139. В качестве основы при производстве стойки СВ 95-3 IV (шифр 20.0139) используется тяжелый бетон класса на сжатие В30, который изготавливается из сульфатостойкого цемента или портландцемента. Марка бетонной смеси по морозостойкости — не менее F200, по водонепроницаемости — W6. Передаточная прочность бетона должна составлять не менее 80% при положительной температуре наружного воздуха и не менее 90% при отрицательной температуре наружного воздуха.
Для повышения прочности, устойчивости к разным типам воздействий, для стойки СВ 95-3 IV (шифр 20.0139) применяется метод армировки бетона. В целом, запроектированные по
а. горячекатаная А-III,А-IV,А-V;
б. упрочненная вытяжкой А-IIIв;
упрочненная вытяжкой А-IIIв;
в. термически упрочненная Ат-IV,Aт-IVK, Ат-V.
Дополнительно, процесс производства СВ 95-3 IV (шифр 20.0139) предусматривает наличие в конструкции специальных монтажных петель, которые упрощают процесс транспортировки и монтажа. Их изготавливают из стали класса А-I.
Готовая стойка проходит технический контроль на заводе-изготовители, по результатам которого ей присваивается паспорт, подтверждающий её качество.
Хранение и транспортировка
Железобетонные вибрированные стойки хранятся по принципу укладки в штабели, с обязательным применением прокладок или деревянных досок, которые выступают в качестве прослоек. Перевозка осуществляется с помощью специального транспорта. Изделия СВ 95-3 IV (шифр 20.0139) должны быть уложены торцами в одну сторону и надежно закреплены. Необходимо руководствоваться всеми мерами предосторожности, которые исключают повреждения железобетонных конструкций.
Уважаемые покупатели! Сайт носит информационный характер. Указанные на сайте информация не являются публичной офертой (ст.435 ГК РФ). Стоимость и наличие товара просьба уточнять в офисе продаж или по телефону 8 (800) 500-22-52
Опоры СВ 95 (95-2, 95-3, 95-3с), СВ 110 (110-35, 110-5), СВ 164 (164-12, 164-20)
Прокладка ЛЭП невозможна без монтажа специальных стоек для линий электропередач. Их качество прямым образом влияет на тот срок, который они способны прослужить. Среди железобетонных столбов для ЛЭП часто используются стойки марки СВ.
Прокладка ЛЭП невозможна без монтажа специальных стоек для линий электропередач. Их качество прямым образом влияет на тот срок, который они способны прослужить. Среди железобетонных столбов для ЛЭП часто используются стойки марки СВ. Данные опоры представлены в нескольких разновидностях, которые отличаются по:
- длине – она определяется в дециметрах и чаще всего в продаже можно встретить варианты длиной от 95 и больше;
- изгибающему моменту;
- маркировке – она позволяет обозначить тип опоры и зачастую имеет несколько букв.

К самым важным характеристикам данных стоек относится их устойчивость к внешним факторам. Стоит выделить сейсмоустойчивость вибрированных опор. Они способны выдержать колебания до 9 баллов. Грамотно установленная опора высокого качества сможет долгий период времени выполнять свои основные функции. Если соблюсти все требования и стандарты, то эксплуатация опор СВ составляет больше 50 лет. Монтажом данных стоек должны заниматься непременно профессионалы. В данной ситуации можно быть спокойным за качество выполненной прокладки или реконструкции ЛЭП.
Особенности опор СВ 95-2, СВ 95-3, СВ 95-3сПеред тем как переходить к самим разновидностям, стоит выяснить, что значит сама маркировка стоек СВ 95. «СВ» расшифровывается как – стойка вибрированная, а цифры 95 указывают на длину стойки в дециметрах. Среди опор СВ 95 стоит выделить 3 разновидности:
- СВ 95-2. Данные опоры используются для прокладки линий, напряжение которых достигает 0,38 кВ.
 Масса одной единицы опоры составляет 0,75 тн., изгибающий момент 2,0 тс*м.
Масса одной единицы опоры составляет 0,75 тн., изгибающий момент 2,0 тс*м. - СВ 95-3. Эти стойки могут использоваться во время строительства и реконструкции ЛЭП. Масса этих стоек больше – 0,90 тн., поскольку у них выше прочность и больше изгибающий момент – 3,0 тс*м. Количество опор доступных для транспортировки в автомобиле 20 тонн — 22 ед.
- СВ 95-3с. Данные стойки также используются во время строительства и восстановления ЛЭП, но от прошлой разновидности опор, стойки СВ 95-3с отличаются тем, что у них меньшая масса – 0,75 тн, изгибающий момент у них идентичен – 3,0 тс*м, но максимальная загрузка в автомобиль 20 тонн больше – 27 ед.
Среди опор СВ с длиной 110 дециметров встречаются 2 разновидности:
- СВ 110-35. Железобетонные стойки СВ 110-35 используются при строительстве и реконструкции ЛЭП с напряжением 0,38 кВ. Масса одной стойки составляет 1,13 тн.
 , изгибающий момент составляет 3,5 тс*м, максимальная загрузка в автомобиль 20 тонн — 18 ед.
, изгибающий момент составляет 3,5 тс*м, максимальная загрузка в автомобиль 20 тонн — 18 ед. - СВ 110-5. Данные стойки представляют собой железобетонный трапециевидный столб, использующийся для прокладки ЛЭП напряжением 0,4-10 кВ. Масса опоры 1,13 тн., но изгибающий момент у нее намного больше, чем у прошлого вида стоек и составляет 5,0 тс*м. Максимальная загрузка в автомобиль 20 тонн — 18 ед.
Стойки вибрированные с длиной в 164 дециметров делятся на 2 вида:
- СВ 164-12. Данные опоры могут использоваться для прокладки ЛЭП с напряжением более 35 кВ. Масса одной стойки составляет 3,55 тн., изгибающий момент равен 12,0 тс*м. Максимальная загрузка в автомобиль 20 тонн — 5 ед.
- СВ 162-20. Этот вид стоек также может применяться для создания ЛЭП с напряжением больше 35 кВ. Эти стойки имеют идентичную массу, как и у прошлого вида, 3,55 тн., но у них самый большой изгибающий момент, чем у всех остальных вибрированных стоек – 20,0 тс*м.

Как видно из вышеперечисленного, основные отличия стоек СВ заключаются в их длине, массе, количестве арматуры, которая влияет на прочность и повышает изгибающий момент.
Стойки опор ЛЭП | Продукция | Каталог продукции
Стойки опор ЛЭП
| Проектная документация | Марка изделия | Размеры, мм | ||
|---|---|---|---|---|
| длина | ширина | высота | ||
| Серия Б 3.407.1-2.01 | СВ 110-35 СВ 110-49 СВ 95-20 СВ 95-25 |
11000 9500 |
175-185 150-165 |
165-280 165-240 |
| Проект 20.0139-05СБ ТУ 5863-007-00113557-94 |
СВ95-3с-А СВ95-3с-А* |
9500 | 150-165 | 165-240 |
| Проект ЛЭП 00.  10-10СБ 10-10СБ ТУ 5863-007-00113557-94 |
CВ 110-5-A | 11000 | 175-185 | 165-280 |
Стойки железобетонные предварительно напряженные для опор ЛЭП напряжением 0,38 кВ и от 6 до 10 кВ включительно, предназначенные для применения при расчетной температуре наружного воздуха (средней температуре воздуха наиболее холодной пятидневки района строительства) до минус 55 °С включительно, сейсмичностью до 7 баллов включительно.
Опоры ЛЭП применяются при строительстве,реконструкции и капитальном ремонте высоковольтных линий электропередач.
Стойки обозначают марками в соответствии с требованиями ГОСТ 23 09. Марка состоит из буквенно-цифровых групп, разделенных дефисами.
Первая группа содержит обозначение типа стойки (СВ — стойка вибрированная) и ее длину в дециметрах.
Во второй группе приводят несущую способность стойки. характеризуемую величиной расчетного изгибающего момента в кН м. округленной до целого числа, и класс напрягаемой арматуры.
В третью группу включают дополнительные характеристики, отражающие особые условия применения стоек, тип защиты стоек от коррозии, варианты армирования, обозначаемые арабскими цифрами и прописными буквами.
Примеры условного обозначения (марки) опоры ЛЭП
Стойка длиной 9500 мм с расчетным изгибающим моментом, равным 19.6 кН м.
СВ 95-20
Стойки CВ 95-3c-А* отличаются от стоек СВ 95-3с-А: торцевые пластины не устанавливаются; в малом торце опоры устанавливается штырь; заземляющие проводники привариваются к выпускам напрягаемого стержня. Стойки выполняются на основе серии Б 3.407.1-2.01 вып.1. Обмазка комлевой части не производится. На изготовление требуется согласование заказчика на указанные изменения.
РАСЧЁТНЫЕ ИЗГИБАЮЩИЕ МОМЕНТЫ СТОЕК
| НАИМЕНОВАНИЕ ИЗДЕЛИЙ | ПРОЕКТНАЯ ДОКУМЕНТАЦИЯ | Марка стойки | Расчётный изгибающий момент, кНм (тс м) | |
|---|---|---|---|---|
| в плоскости большей жёсткости | в плоскости меньшей жёсткости | |||
| Стойки опор ЛЭП СТБ 1247-2000 | Б 3. 407.1-2.01 в. 1 407.1-2.01 в. 1 |
СВ 110-35 | 35.0 (3.5) | 22.0 (2.2) |
| СВ 110-49 | 49.0 (5.0) | 35 (3.5) | ||
| СВ 95-20 | 19.6 (2.0) | 11.8 (1.2) | ||
| СВ 95-25 | 25.0 (2.65) | 15.0 (1.53) | ||
| Б 3.407.1-2.01 в.2 | СВ 110-35-1Э | 35.0 (3.5) | 22.0 (2.2) | |
| СВ 110-35-2Э | ||||
| СВ 110-50-1Э | 50 (5.0) | 35.0 (3.5) | ||
| СВ 110-50-2Э | ||||
| СВ 95-20-1Э | 19. 6 (2.0) 6 (2.0) |
11.8 (1.2) | ||
| СВ 95-20-2Э | ||||
| СВ 95-30-1Э | 30 (3.0) | 17.0 (1.7) | ||
| СВ 95-30-2Э | ||||
| Стойки опор ЛЭП ТУ 5863-007-00113557-94 | 20.0139-05 | СВ 95-3с-А* | 30 (3.0) | 20 (2.0) |
| СВ 95-3с-А | ||||
| ЛЭП98.08-08 | СВ 95-3с | |||
| ЛЭП98.08-08 | СВ 110-5-А | 50 (5.0) | 35 (3.5) | |
Сертификат соответствия
Диплом
Диплом РФ-2014=СВ
| П10-1 П10-2 УП10-1 А10-1 УА10-1 ОА10-1 УОА10-1 П10/0,38 УП10/0,38 А10/0,38 УА10/0,38 ОА10/0,38 П10-3 П10-4 УП10-2 ОА10-2 А10-2 УА10-2 УОА10-2 П10-5 УП10-3 ОА10-3 А10-3 УА10-3 УОА10-3 П16,4-1 УП16,4-1 К16,4-1 А16,4-1 ПП10-1 ПП10-2 ПП10-3 ПП10-4 ПП10-5 ПП10-6 ПС10-1 ПС10-2 ПУП10-1 ПА10-1 ПА10-2 ПА10-3 ПА10-4 ПА10-5 ПУА10-1 ПУА10-2 2П10-1 2ОП10-1 2ОП10-2 2ОП10-3 2УП10-1 2А10-1 2К10-1 П10-1Б УП10-1 А10-1 УА10-1 ОА10-1 УОА10-1 П10/0,38 УП10/0,38 А10/0,38 УА10/0,38 ОА10/0,38 П10-3 П10-4 УП10-2 ОА10-2 А10-2 УА10-2 УОА10-2 П10-5 УП10-3 ОА10-3 А10-3 УА10-3 УОА10-3 П16,4-1 УП16,4-1 К16,4-1 А16,4-1 ПП10-1 ПП10-2 ПП10-3 ПП10-4 ПП10-5 ПП10-6 ПС10-1 ПС10-2 ПУП10-1 ПА10-1 ПА10-2 ПА10-3 ПА10-4 ПА10-5 ПУА10-1 ПУА10-2 2П10-1 | 1 1 2 2 3 2 3 1 2 2 3 2 1 1 2 2 2 3 3 1 2 2 2 3 3 1 1 1 1 1 1 3 1 1 1 1 1 1 2 2 2 1 2 3 1 1 1 1 1 2 1 1 1 2 2 3 2 3 1 2 2 3 2 1 1 2 2 2 3 3 1 2 2 2 3 3 1 1 1 1 1 1 3 1 1 1 1 1 1 2 2 2 1 2 3 1 1 | СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ105-3,5; СВ105 СВ105 СВ105 СНВ7-13 СВ164-12 СВ164-12 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ164-12 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СНВ7-13 СВ164-12 СВ164-12 СНВ7-13 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ110-2,5 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СВ110-3,5 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СНВ7-13 СВ164-12 СВ164-12 СВ164-12 СВ164-12 СВ105-3,5; СВ105 СВ105 СВ105 СНВ7-13 СВ164-12 СВ164-12 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СВ164-12 СВ105-3,5; СВ105 СВ105-3,5; СВ105 СНВ7-13 СВ164-12 СВ164-12 СНВ7-13 СВ164-12 СВ164-12 | 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 11 11 11 11 11 11 11 13 13 13 13 13 13 16,4 16,4 16,4 16,4 10,5 10,5 10,5 13 16,4 16,4 10,5 10,5 16,4 10,5 10,5 13 16,4 16,4 13 16,4 16,4 16,4 16,4 16,4 16,4 16,4 16,4 11 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 10,5 11 11 11 11 11 11 11 13 13 13 13 13 13 16,4 16,4 16,4 16,4 10,5 10,5 10,5 13 16,4 16,4 10,5 10,5 16,4 10,5 10,5 13 16,4 16,4 13 16,4 16,4 | 7,75 8,25 8,05 7,55 7,55 7,55 7,15 7 7,2 7,2 7,2 7,2 7,6 8,1 8,6 9,15 8,1 8,1 7,75 8,2 8,7 8,55 9,05 9,05 8,2 9,7 8,3 9,95 9,95 10,85 9,85 8,2 11 12,3 12 6,8 7,8 12,35 9,4 7,5 10 12,3 12,1 10 12,3 8,1 8,1 8,1 8,1 8,1 8,85 8,85 8,05 | 0,47 0,47 1,04 1,04 1,56 1,04 1,56 0,47 1,04 1,04 1,56 1,04 0,45 0,45 1,00 1,00 1,00 1,50 1,50 0,75 1,50 1,60 1,60 2,40 2,40 1,42 1,71 1,71 1,71 0,87 0,47 1,41 0,75 1,42 1,42 0,47 0,47 1,59 1,46 0,94 1,60 1,71 2,89 2,40 1,83 1,42 1,42 1,42 1,42 2,84 1,71 1,71 8,25 1,04 1,04 1,56 1,04 1,56 0,47 1,04 1,04 1,56 1,04 0,45 0,45 1,00 1,00 1,00 1,50 1,50 0,75 1,50 1,60 1,60 2,40 2,40 1,42 1,71 1,71 1,71 0,87 0,47 1,41 0,75 1,42 1,42 0,47 0,47 1,59 1,46 0,94 1,60 1,71 2,89 2,40 1,83 1,42 | 18 22 48 50 63 66 92 71 105 126 149 194 17 21 47 66 49 66 89 65 88 129 70 99 135 65 228 249 250 42 79 27 32 46 83 14 16 131 81 124 72 218 103 99 311 125 125 182 182 123 297 317 0,47 48 50 63 66 92 71 105 126 149 194 17 21 47 66 49 66 89 65 88 129 70 99 135 65 228 249 250 42 79 27 32 46 83 14 16 131 81 124 72 218 103 99 311 125 |
Оценка показателей клеточного иммунитета.
 Гематологическое исследование, цены в CMD
Гематологическое исследование, цены в CMDПервым исследованием всегда является подсчет лейкоцитарной формулы (см. главу «Гематологические исследования»). Оцениваются как относительные, так и абсолютные значения количества клеток периферической крови.
Определение основных популяций (Т-клетки, В-клетки, натуральные киллеры) и субпопуляций Т-лимфоцитов (Т-хелперы, Т-ЦТЛ). Для первичного исследования иммунного статуса и выявления выраженных нарушений иммунной системы ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Метод исследования
Иммунофенотипирование лимфоцитов проводится c использованием моноклональных антител к поверхностным дифференцировочным ангинам на клетках иммунной системы, методом проточной лазерной цитофлуорометрии на проточных цитофлуориметрах.
Выбор зоны анализа лимфоцитов производится по дополнительному маркеру CD45, который представлен на поверхности всех лейкоцитов.
Условия взятия и хранения образцов
Венозная кровь, взятая из локтевой вены, утром, строго натощак, в вакуумную систему до указанной на пробирке метки. В качестве антикоагулянта используется К2ЭДТА. После взятия пробирку с образцом медленно переворачивают 8-10 раз для перемешивония крови с антикоагулянтом. Хранение и транспортировка строго при 18–23°С в вертикальном положении не более 24 ч.
Невыполнение этих условий приводит к некорректным результатам.
Интерпретация результатов
Т-лимфоциты (CD3+ клетки). Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки) Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, при новообразованиях иммунной системы, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+ Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+ Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+ Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Соотношение CD4+/CD8+ Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.
Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе.
Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.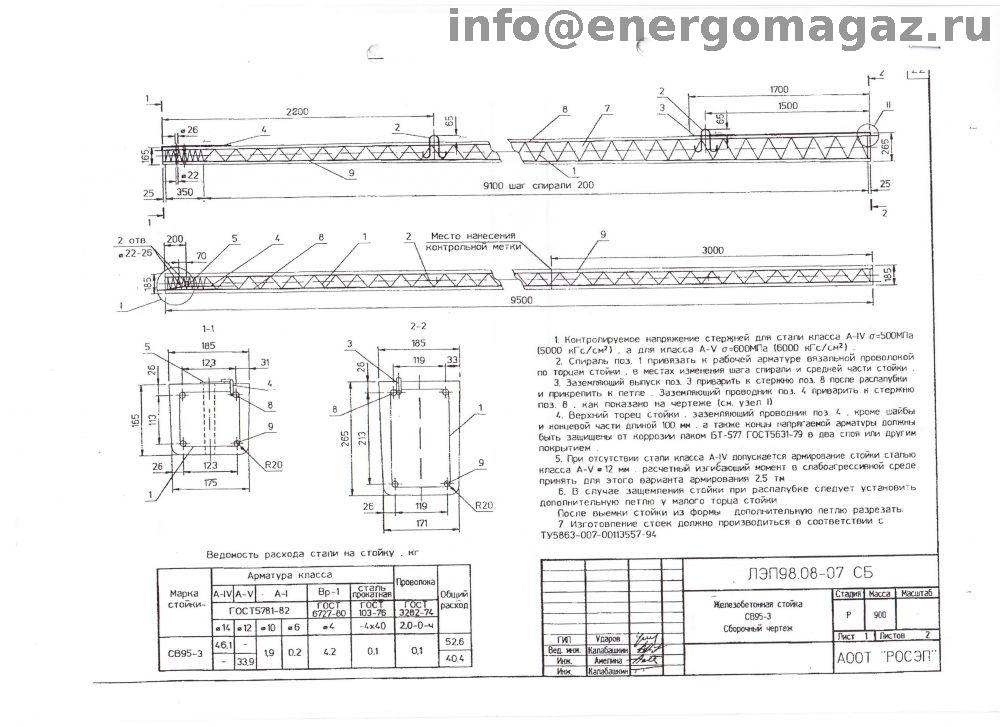
Т-активированные лимфоциты с фенотипом CD3+HLA-DR+ Маркер поздней активации, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
ТNK-лимфоциты с фенотипом CD3+CD16++CD56+ Т-лимфоциты, несущие на своей поверхности маркеры CD16++ CD 56+. Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Снижение их в периферической крови может наблюдаться при различных органоспецифических заболеваниях и системных аутоиммунных процессах. Увеличение отмечено при воспалительных заболеваниях разной этиологии, опухолевых процессах.
Увеличение отмечено при воспалительных заболеваниях разной этиологии, опухолевых процессах.
Исследование ранних и поздних маркеров активации Т-лимфоцитов (CD3+CD25+, CD3-CD56+, CD95, CD8+CD38+) дополнительно назначают для оценки изменений ИС при острых и хронических заболеваниях, для диагностики, прогноза, мониторинга течения заболевания и проводимой терапии.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к ИЛ2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+ Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Рецептор CD95+ – один из рецепторов апоптоза. Апоптоз – сложный биологический процесс, необходимый для удаления из организма поврежденных, старых и инфицированных клеток. Рецептор CD95 экспрессируется на всех клетках иммунной системы. Он играет важную роль в контроле функционирования иммунной системы, так как является одним из рецепторов апоптоза. Его экспрессия на клетках определяет готовность клеток к апоптозу.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.
Активированные лимфоциты CD3+CDHLA-DR+, CD8+CD38+, CD3+CD25+, CD95. Тест отражает функциональное состояние Т-лимфоцитов и рекомендован для контроля за течением заболевания и контроля иммунотерапии при воспалительных заболеваниях разной этиологии.
| НАИМЕНОВАНИЕ ПАРАМЕТРА | ЗНАЧЕНИЕ ПАРАМЕТРА | |
|---|---|---|
| Напряжение сети | (150…253) В | |
| Выходное напряжение | при питании от сети | (13,6±0,6) В |
| при питании от АБ | (10…13,6) В | |
| Номинальный выходной ток | 3 А | |
Максимальный выходной ток (10 мин. ) ) | 4 А | |
| Максимальная мощность, потребляемая от сети | 120 ВА | |
| Собственный ток потребления от АБ | не более 40 мА | |
| Емкость АБ | 17 А·ч | |
| Световая индикация | 5 светодиодных индикатора для отображения режимов работы и неисправностей | |
| Встроенный звуковой сигнализатор | есть | |
| Датчик вскрытия корпуса | есть | |
| Интерфейс | RS-485, протокол Орион | |
| Буфер событий | 95 событий | |
| Релейный выход («Неисправность») | 1 шт., оптореле | |
| Максимальные напряжение и ток коммутации реле | (80 В, 50 мА) | |
| Время технической готовности | не более 6 с | |
| Рабочий диапазон температур | от -10 до +40 °C | |
| Относительная влажность | до 90% при +25 °C | |
| Степень защиты корпуса | IР30 | |
| Габаритные размеры | 255х310х95 мм | |
| Вес РИП | не более 2,5 кг (с батареей не более 8,5 кг) | |
| Средний срок службы | 10 лет | |
| Программирование РИП | Программа UProg. exe exe | |
| Подключение к ПК при программировании | Через интерфейс RS-485 с помощью преобразователя интерфейсов | |
| Тип подключения к РИП | Клеммные колодки под винт Подключение к сети: провод 0,75…2,5 кв.мм Подключение нагрузки: провод 0,5…2,5 кв.мм Подключение RS-485, реле К1: провод 0,2…2,5 кв.мм | |
| Тип монтажа | настенный, навесной | |
Бета-субъединица хорионического гонадотропина человека (бета-ХГЧ)
Бета-субъединица хорионического гонадотропина человека – одна из субъединиц молекулы специфического гормона – хорионического гонадотропина, образующегося в оболочке человеческого эмбриона. Анализ проводят в целях ранней диагностики беременности, выявления ее осложнений и диагностики заболеваний, связанных с нарушением секреции ХГЧ.
Синонимы русские
Бета-субъединица ХГ.
Синонимы английские
Human Chorionic Gonadotropin, hCG, b-HCG, Quantitative hCG; Beta hCG, Total hCG, Total beta hCG.
Метод исследования
Электрохемилюминесцентный иммуноанализ (ECLIA).
Диапазон определения: 0,1 — 1000000 МЕ/л.
Единицы измерения
МЕ/л (международная единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Хорионический гонадотропин человека (ХГЧ) – это гормон, который вырабатывается в плодной оболочке человеческого эмбриона. Он является важным показателем развития беременности и ее отклонений. Его производят клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки (это происходит лишь через несколько дней после оплодотворения). Зародыш на этом этапе беременности представляет собой заполненный жидкостью микроскопический пузырек, стенки которого состоят из быстро размножающихся клеток. Из одной части этих клеток и развивается будущий ребенок (эмбриобласт), в то время как из клеток, находящихся снаружи зародыша, образуется трофобласт – та часть плодного яйца, с помощью которого оно прикрепляется к стенке матки. В дальнейшем из трофобласта образуется хорион.
Из одной части этих клеток и развивается будущий ребенок (эмбриобласт), в то время как из клеток, находящихся снаружи зародыша, образуется трофобласт – та часть плодного яйца, с помощью которого оно прикрепляется к стенке матки. В дальнейшем из трофобласта образуется хорион.
Хорион выполняет функцию питания зародыша, являясь посредником между организмом матери и ребенка. Кроме того, он вырабатывает хорионический гонадотропин, который, с одной стороны, влияет на формирование ребенка, с другой – специфическим образом воздействует на организм матери, обеспечивая благополучное протекание беременности. Появление этого гормона в организме будущей матери на начальной стадии беременности и объясняет важность теста для ранней диагностики беременности.
Хорионический гонадотропин стимулирует секреторную функцию желтого тела яичников, которое должно продуцировать гормон прогестерон, поддерживающий нормальное состояние внутренней оболочки стенки матки – эндометрия. Эндометрий обеспечивает надежное прикрепление плодного яйца к организму матери и его питание всеми необходимыми веществами.
Благодаря достаточному количеству хорионического гонадотропина желтое тело, в норме существующее лишь около 2 недель в течение каждого менструального цикла, при успешном зачатии не подвергается рассасыванию и остается функционально активным в течение всего срока беременности. Причем именно у беременных под влиянием хорионического гонадотропина оно производит очень большие количества прогестерона. Кроме того, ХГ стимулирует продукцию эстрогенов и слабых андрогенов клетками яичников и способствует развитию функциональной активности самого хориона, а в дальнейшем и плаценты, которая образуется в результате созревания и разрастания хориональной ткани, улучшая ее собственное питание и увеличивая количество ворсин хориона.
Таким образом, роль хорионического гонадотропина заключается в специфическом и многостороннем воздействии на организм женщины и плода в целях успешного протекания беременности. На основании анализа на хорионический гонадотропин определяется присутствие в организме женщины хорионической ткани, а значит, и беременность.
По химическому строению хорионический гонадотропин является соединением белка и сложных углеводов, состоящим из двух частей (субъединиц): альфы и беты. Альфа-субъединица хорионического гонадотропина полностью идентична альфа-субъединицам лютеинизирующего, фолликулостимулирующего и тиреотропного гормонов гипофиза, которые выполняют функции, во многом сходные с функцией хорионического гонадотропина, но не при беременности. Бета-субъединица хорионического гонадотропина уникальна, что, с одной стороны, обуславливает специфичность его действия, а с другой – позволяет идентифицировать его в биологических средах. В связи с этим данный тест носит название «бета-субъединица хорионического гонадотропина (бета-ХГЧ)».
Зная уровень бета-ХГЧ в крови, можно уже на 6-8-й день после зачатия диагностировать беременность (в моче концентрация бета-ХГЧ достигает диагностического уровня на 1-2 дня позже). В норме при беременности в период между 2-й и 5-й неделей количество бета-ХГЧ удваивается каждые 1,5 суток. При многоплодной беременности оно увеличивается пропорционально числу плодов. Максимума уровень ХГЧ достигает на 10-11-ю неделю, а затем постепенно снижается. Это происходит в связи с тем, что с начала 2-й трети беременности плацента способна самостоятельно продуцировать достаточно эстрогенов и прогестерона, при участии которых эндометрий нормально функционирует независимо от секреции гормонов в желтом теле яичников. Тогда же концентрация ХГ в крови беременной женщины постепенно снижается, а желтое тело может функционировать без воздействия ХГ. В этот период роль гормона заключается в стимуляции производства тестостерона у плода, что необходимо для нормального развития наружных половых органов эмбриона.
При многоплодной беременности оно увеличивается пропорционально числу плодов. Максимума уровень ХГЧ достигает на 10-11-ю неделю, а затем постепенно снижается. Это происходит в связи с тем, что с начала 2-й трети беременности плацента способна самостоятельно продуцировать достаточно эстрогенов и прогестерона, при участии которых эндометрий нормально функционирует независимо от секреции гормонов в желтом теле яичников. Тогда же концентрация ХГ в крови беременной женщины постепенно снижается, а желтое тело может функционировать без воздействия ХГ. В этот период роль гормона заключается в стимуляции производства тестостерона у плода, что необходимо для нормального развития наружных половых органов эмбриона.
Таким образом, в течение беременности уровень бета-ХГЧ в крови сначала нарастает и затем снижается. По этому показателю можно судить о благополучном течении беременности и выявлять нарушения развития плода. Тест на ХГ в крови – наиболее достоверный метод определения беременности на ранних сроках. ХГ появляется в организме женщины c 6-8-го дня после оплодотворения. Распространенный экспресс-тест на беременность, которым может воспользоваться каждая женщина в домашних условиях, тоже основан на измерении ХГ в моче.
ХГ появляется в организме женщины c 6-8-го дня после оплодотворения. Распространенный экспресс-тест на беременность, которым может воспользоваться каждая женщина в домашних условиях, тоже основан на измерении ХГ в моче.
Уровни гормона ниже нормы на различных этапах развития плода позволяют сделать предположение об эктопической беременности, задержке в развитии плода, угрозе самопроизвольного аборта, неразвивающейся беременности или недостаточности функции плаценты. Причиной повышенного содержания бета-ХГЧ может быть токсикоз, сахарный диабет или неправильно установленный срок беременности. Высокий уровень гормона после мини-аборта указывает на прогрессирующую беременность.
Определение уровня ХГ входит в тройной тест-исследование, по результатам которого можно судить о некоторых аномалиях развития плода, но точный диагноз поставить нельзя. Исследование лишь позволяет отнести женщину к группе риска по данной патологии. В этом случае необходимо дальнейшее обследование. У небеременных в норме ХГ отсутствует, однако он может секретироваться некоторыми аномальными тканями, происходящими из хориона (пузырным заносом, хорионэпителиомой), и некоторыми другими опухолями.
Для чего используется исследование?
- Для диагностики беременности, в том числе многоплодной, внематочной и неразвивающейся.
- Для наблюдения за ходом беременности.
- Для выявления задержек в развитии плода, угрозы самопроизвольного аборта, недостаточности функции плаценты.
- Для диагностики аменореи.
- Для контроля за эффективностью искусственного аборта.
- Как часть комплексного обследования по выявлению пороков развития плода.
- Для диагностики опухолей, продуцирующих ХГ.
Когда назначается исследование?
- При подозрении на беременность, в частности многоплодную.
- При контроле за ходом беременности.
- Когда возникает предположение об осложнении при беременности: задержке развития плода, угрозе самопроизвольного аборта, неразвивающейся или внематочной беременности, хронической недостаточности функции плаценты.
- При необходимости подтвердить успешное проведение искусственного аборта.

- При комплексном обследовании по выявлению пороков развития плода.
- При выяснении причины отсутствия менструаций (аменореи).
- Когда проводится диагностика опухолей, продуцирующих ХГ.
Что означают результаты?
Референсные значения
|
Пол |
Неделя беременности (с момента зачатия) |
Референсные значения |
|
Женский |
Не беременные |
Менее 5 МЕ/л |
|
3 недели |
5,8 — 71,2 МЕ/л |
|
|
4 недели |
9,5 — 750 МЕ/л |
|
|
5 недель |
217 — 7138 МЕ/л |
|
|
6 недель |
158 — 31795 МЕ/л |
|
|
7 недель |
3697 — 163563 МЕ/л |
|
|
8 недель |
32065 — 149571 МЕ/л |
|
|
9 недель |
63803 — 151410 МЕ/л |
|
|
10 недель |
46509 — 186977 МЕ/л |
|
|
11-12 недель |
27832 — 210612 МЕ/л |
|
|
13-14 недель |
13950 — 62530 МЕ/л |
|
|
15 недель |
12039 — 70971 МЕ/л |
|
|
16 недель |
9040 — 56451 МЕ/л |
|
|
17 недель |
8175 — 55868 МЕ/л |
|
|
18 недель |
8099 — 58176 МЕ/л |
|
|
Мужской |
|
Менее 5 МЕ/л |
Причины повышения уровня бета-ХГЧ
При отсутствии беременности результат теста на бета-ХГЧ должен быть отрицательным. Выявление же бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней. Между 2-й и 5-й неделей беременности при ее нормальном течении уровень бета-ХГЧ удваивается каждые 1,5 суток и вскоре достигает своего максимума. Затем он начинает медленно снижаться. Результаты анализа сравниваются с показателями нормы для каждого срока беременности. Для верной трактовки результатов необходимо точно знать, когда произошло зачатие.
Выявление же бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней. Между 2-й и 5-й неделей беременности при ее нормальном течении уровень бета-ХГЧ удваивается каждые 1,5 суток и вскоре достигает своего максимума. Затем он начинает медленно снижаться. Результаты анализа сравниваются с показателями нормы для каждого срока беременности. Для верной трактовки результатов необходимо точно знать, когда произошло зачатие.
У беременных:
- многоплодная беременность (показатель возрастает пропорционально числу плодов),
- токсикоз,
- пролонгированная беременность,
- сахарный диабет у матери,
- пороки развития плода,
- прием синтетических гормонов.
Не у беременных:
- опухоли, продуцирующие ХГ,
- хирургический аборт (первые 4-5 суток после процедуры),
- прием препаратов ХГЧ.
Причины понижения уровня бета-ХГЧ (при беременности):
- внематочная или неразвивающаяся беременность,
- задержка в развитии плода,
- угроза самопроизвольного аборта,
- хроническая плацентарная недостаточность,
- гибель плода (во 2-3-м триместре беременности).

Что может влиять на результат?
- При диагностике беременности слишком раннее выполнение теста – когда прошло менее 5 дней с зачатия – может привести к ложноотрицательному результату.
Наибольшее количество образующихся поли (A) + РНК транскрибируется РНК-полимеразой III в опухолевых клетках мышей.
Nucleic Acids Res. 1990 Aug 11; 18 (15): 4499–4506.
Институт молекулярной биологии им. Энгельгардта АН СССР, Москва.
Эта статья цитируется в других статьях в PMC.Abstract
От двенадцати до двадцати процентов вновь синтезированной поли (A) + РНК транскрибируется с помощью РНК-полимеразы III в опухолях мышей асцитной карциномы Эрлиха и плазмоцитомы P3O1.Большая часть этой РНК, обозначаемой как pol IIIpoly (A) + РНК, имеет размер от 160 до 800 нуклеотидов с максимальным распределением примерно ок. 300 нуклеотидов. Фракция Pol IIIpoly (A) + РНК состоит из двух основных классов молекул, соответствующих ранее описанным РНК B1 и РНК B2 в соотношении от 1: 4 до 2: 3. Все B2 РНК, присутствующие во фракции поли (А) +, содержат длинные сегменты поли (А) на 3′-концах. Таким образом, транскрипты РНК-полимеразы III могут быть полиаденилированы. Несколько транскриптов, которые гибридизуются с зондом B2, также наблюдались в поли (A) — РНК.Основные компоненты состоят из 180, 160, 120 и 95 нуклеотидов. РНК В2 из 180 нуклеотидов, по-видимому, является первичным транскриптом из повтора В2. Мы предполагаем, что другие РНК B2 транскрибируются с усеченных копий элемента B2.
Все B2 РНК, присутствующие во фракции поли (А) +, содержат длинные сегменты поли (А) на 3′-концах. Таким образом, транскрипты РНК-полимеразы III могут быть полиаденилированы. Несколько транскриптов, которые гибридизуются с зондом B2, также наблюдались в поли (A) — РНК.Основные компоненты состоят из 180, 160, 120 и 95 нуклеотидов. РНК В2 из 180 нуклеотидов, по-видимому, является первичным транскриптом из повтора В2. Мы предполагаем, что другие РНК B2 транскрибируются с усеченных копий элемента B2.
Полный текст
Полный текст доступен в виде отсканированной копии оригинальной печатной версии. Получите копию для печати (файл PDF) полной статьи (1,9M) или щелкните изображение страницы ниже, чтобы просмотреть страницу за страницей. Ссылки на PubMed также доступны для Избранные ссылки .
Изображения в этой статье
Щелкните изображение, чтобы увидеть его в увеличенном виде.
Избранные ссылки
Эти ссылки находятся в PubMed. Это может быть не полный список ссылок из этой статьи.
Это может быть не полный список ссылок из этой статьи.
- Браверман Г. Роль последовательности поли (А) в матричной РНК млекопитающих. CRC Crit Rev Biochem. 1981; 10 (1): 1–38. [PubMed] [Google Scholar]
- Крамеров Д.А., Григорян А.А., Рысков А.П., Георгиев Г.П. Длинные двухцепочечные последовательности (дцРНК-B) ядерной пре-мРНК состоят из нескольких очень распространенных классов последовательностей: данные экспериментов по клонированию ДНК.Nucleic Acids Res. 1979 Февраль; 6 (2): 697–713. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Краев А.С., Крамеров Д.А., Скрябин К.Г., Рысков А.П., Баев А.А., Георгиев Г.П. Нуклеотидная последовательность повсеместно повторяющейся последовательности ДНК B1, комплементарная наиболее распространенному классу складчатой РНК мыши. Nucleic Acids Res. 1980 25 марта; 8 (6): 1201–1215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Краев А.С., Маркушева Т.В., Крамеров Д.А., Рысков А.П., Скрябин К.Г., Баев А.
 А., Георгиев Г.П. Вездесущие транспозоноподобные повторы B1 и B2 генома мыши: секвенирование B2.Nucleic Acids Res. 11 декабря 1982 г .; 10 (23): 7461–7475. [Бесплатная статья PMC] [PubMed] [Google Scholar]
А., Георгиев Г.П. Вездесущие транспозоноподобные повторы B1 и B2 генома мыши: секвенирование B2.Nucleic Acids Res. 11 декабря 1982 г .; 10 (23): 7461–7475. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Haynes SR, Jelinek WR. Низкомолекулярные РНК, транскрибируемые in vitro РНК-полимеразой III из диспергированных повторов Alu-типа в ДНК китайского хомячка, также обнаруживаются in vivo. Proc Natl Acad Sci U S. A. 1981, октябрь; 78 (10): 6130–6134. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Крамеров Д.А., Леках И.В., Самарина О.П., Рысков А.П. Последовательности, гомологичные основным вкрапленным повторам B1 и B2 генома мыши, присутствуют в мРНК и малой цитоплазматической поли (A) + РНК.Nucleic Acids Res. 1982, 11 декабря; 10 (23): 7477–7491. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Крамеров Д.А., Тиллиб С.В., Рысков А.П., Георгиев Г.П. Нуклеотидная последовательность малой полиаденилированной РНК B2. Nucleic Acids Res. 1985 25 сентября; 13 (18): 6423–6437.
 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] - Крамеров Д.А., Тиллиб С.В., Леках И.В., Рысков А.П., Георгиев Г.П. Биосинтез и цитоплазматическое распределение малой поли (A) -содержащей B2 РНК. Biochim Biophys Acta. 1985 20 февраля; 824 (2): 85–98. [PubMed] [Google Scholar]
- Зильбер Э., Веско К., Пенман С.Селективное ингибирование синтеза митохондриально-ассоциированной РНК бромидом этидия. J Mol Biol. 1969, 28 августа; 44 (1): 195–204. [PubMed] [Google Scholar]
- Мукерджи Х., Голдфедер А. Очистка и свойства полимеразы рибонуклеиновой кислоты из митохондрий печени крысы. Биохимия. 1973, 4 декабря; 12 (25): 5096–5101. [PubMed] [Google Scholar]
- Contreras R, Fiers W. Инициирование транскрипции РНК-полимеразой II в проницаемых, инфицированных SV40 или неинфицированных клетках CVI; доказательства наличия множественных промоторов поздней транскрипции SV40.Nucleic Acids Res. 1981, 24 января; 9 (2): 215–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- SCHERRER K, DARNELL JE.
 Седиментационные характеристики быстро меченой РНК из клеток HeLa. Biochem Biophys Res Commun. 1962 г., 4 июня; 7: 486–490. [PubMed] [Google Scholar]
Седиментационные характеристики быстро меченой РНК из клеток HeLa. Biochem Biophys Res Commun. 1962 г., 4 июня; 7: 486–490. [PubMed] [Google Scholar] - Штраус Дж. Х., младший, Келли Р. Б., Синшаймер Р. Л.. Денатурация РНК диметилсульфоксидом. Биополимеры. 1968 июн; 6 (6): 793–807. [PubMed] [Google Scholar]
- Рэйв Н., Црквеняков Р., Боедткер Х. Идентификация мРНК проколлагена, перенесенных на диазобензилоксиметиловую бумагу из гелей формальдегид-агарозы.Nucleic Acids Res. 1979, 10 августа; 6 (11): 3559–3567. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Burckhardt J, Telford J, Birnstiel ML. Обнаружение меченых видов РНК путем контактной гибридизации. Nucleic Acids Res. 11 июля 1979 г .; 6 (9): 2963–2971. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Furdon PJ, Kole R. Снятие отпечатков пальцев РНК с использованием небольшого горизонтального аппарата для электрофореза в агарозном геле. Анальная биохимия. 1987 Апрель; 162 (1): 74–79. [PubMed] [Google Scholar]
- Крамеров Д.
 А., Букринский М.И., Рысков А.П.Последовательности ДНК, гомологичные длинной двухцепочечной РНК. Транскрипция внутрицистернальных генов А-частиц и большого длинного повтора генома мыши. Biochim Biophys Acta. 3 октября 1985 г., 826 (1): 20–29. [PubMed] [Google Scholar]
А., Букринский М.И., Рысков А.П.Последовательности ДНК, гомологичные длинной двухцепочечной РНК. Транскрипция внутрицистернальных генов А-частиц и большого длинного повтора генома мыши. Biochim Biophys Acta. 3 октября 1985 г., 826 (1): 20–29. [PubMed] [Google Scholar] - Зиве Г., Бенеке Б.Дж., Пенман С. Синтез двух классов малых видов РНК in vivo и in vitro. Биохимия. 1977, 4 октября; 16 (20): 4520–4525. [PubMed] [Google Scholar]
- Вайнманн Р., Рёдер Р.Г. Роль ДНК-зависимой РНК-полимеразы 3 в транскрипции генов тРНК и 5S РНК.Proc Natl Acad Sci U S. A. 1974 May; 71 (5): 1790–1794. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Кэри MF, Singh K, Botchan M, Cozzarelli NR. Индукция специфической транскрипции РНК-полимеразой III в трансформированных клетках. Mol Cell Biol. 1986 сентябрь; 6 (9): 3068–3076. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Сакамото К., Окада Н. Семейство Alu грызунов 2 типа, идентификационная последовательность крысы, семейство C кролика и бычий или козий повтор из 73 п.
 н., возможно, произошли от генов тРНК. J Mol Evol. 1985. 22 (2): 134–140.[PubMed] [Google Scholar]
н., возможно, произошли от генов тРНК. J Mol Evol. 1985. 22 (2): 134–140.[PubMed] [Google Scholar] - Дэниэлс Г.Р., Дейнингер П.Л. Семейства повторяющихся последовательностей, происходящие от генов тРНК млекопитающих. Природа. 317 (6040): 819–822. [PubMed] [Google Scholar]
- Шейнесс Д., Пакетт Л., Дарнелл Дж. Э. Возможная связь укорочения поли (A) с оборотом мРНК. Proc Natl Acad Sci U S. A. 1975 Mar; 72 (3): 1077–1081. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Григорян М.С., Крамеров Д.А., Тульчинский Е.М., Ревасова Е.С., Луканидин Е.М. Активация предполагаемого промежуточного образования транспозиции в опухолевых клетках.EMBO J. 1985 сентябрь; 4 (9): 2209–2215. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Edwards DR, Parfett CL, Denhardt DT. Регуляция транскрипции двух индуцированных сывороткой РНК в фибробластах мыши: эквивалентность одного вида повторяющимся элементам B2. Mol Cell Biol. 1985 ноя; 5 (11): 3280–3288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Fornace AJ, Jr, Mitchell JB.
 Индукция транскрипции B2 РНК-полимеразы III тепловым шоком: обогащение последовательностей, индуцированных тепловым шоком, в клетках грызунов путем вычитания гибридизации.Nucleic Acids Res. 25 июля 1986 г .; 14 (14): 5793–5811. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Индукция транскрипции B2 РНК-полимеразы III тепловым шоком: обогащение последовательностей, индуцированных тепловым шоком, в клетках грызунов путем вычитания гибридизации.Nucleic Acids Res. 25 июля 1986 г .; 14 (14): 5793–5811. [Бесплатная статья PMC] [PubMed] [Google Scholar] - Clemens MJ. Потенциальная роль РНК, транскрибируемой из повторов B2, в регуляции стабильности мРНК. Клетка. 1987, 24 апреля; 49 (2): 157–158. [PubMed] [Google Scholar]
- Кэри М.Ф., Сингх К. Усиление транскрипции B2 в клетках, трансформированных обезьяньим вирусом 40, опосредуется образованием комплексов транскрипции РНК-полимеразы III на ранее неактивных генах. Proc Natl Acad Sci U S. A. 1988 Октябрь; 85 (19): 7059–7063.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sisodia SS, Sollner-Webb B, Cleveland DW. Специфичность путей созревания РНК: РНК, транскрибируемые РНК-полимеразой III, не являются субстратами для сплайсинга или полиаденилирования. Mol Cell Biol. Октябрь 1987 г .; 7 (10): 3602–3612.
 [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] - Lewis ED, Manley JL. Полиаденилилирование предшественника мРНК происходит независимо от транскрипции РНК-полимеразой II in vivo. Proc Natl Acad Sci U S. A. 1986, ноябрь; 83 (22): 8555–8559.[Бесплатная статья PMC] [PubMed] [Google Scholar]
- Christofori G, Keller W. 3′-расщепление и полиаденилирование предшественников мРНК in vitro требует поли (A) -полимеразы, фактора расщепления и snRNP. Клетка. 1988 9 сентября; 54 (6): 875–889. [PubMed] [Google Scholar]
- Ryner LC, Takagaki Y, Manley JL. Последовательности ниже сигналов AAUAAA влияют на расщепление пре-мРНК и полиаденилирование in vitro как прямо, так и косвенно. Mol Cell Biol. 1989 апр; 9 (4): 1759–1771. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Sheets MD, Wickens M.Две фазы в добавлении поли (А) хвоста. Genes Dev. 1989 сентябрь; 3 (9): 1401–1412. [PubMed] [Google Scholar]
- Редди Р., Хеннинг Д., Тан Э., Буш Х. Идентификация сайта связывания белка La в транскрипте РНК-полимеразы III (4,5 I РНК).
 J Biol Chem. 10 июля 1983 г .; 258 (13): 8352–8356. [PubMed] [Google Scholar]
J Biol Chem. 10 июля 1983 г .; 258 (13): 8352–8356. [PubMed] [Google Scholar] - Мэтьюз MB, Francoeur AM. La-антиген распознает и связывается с 3′-олигоуридилатным хвостом малой РНК. Mol Cell Biol. 1984 июн; 4 (6): 1134–1140. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Статьи из исследования нуклеиновых кислот предоставлены здесь с разрешения Oxford University Press
РНК-полимераза III транскрипция и рак
Акусярви Г., Свенссон С. и Найгард О.(1987). Мол. Клетка. Биол. , 7 , 549–551.
Allende JE и Allende CC. (1995). FASEB J. , 9 , 313–323.
Altmann GG и Leblond CP. (1982). J. Cell Sci. , 56 , 83–99.
Arrand JR и Rymo L. (1982). J. Virol. , 41, , 376–389.
Бейтс С. и Петерс Г. (1995). Семин. Cancer Biol. , 6 , 73–82.
Байер Р., Бургин А. , Кирмайер А., Феро М., Карсунки Х., Саффрич Р., Морой Т., Ансорге В., Робертс Дж. И Эйлерс М. (2000). EMBO J. , 19 , 5813–5823.
, Кирмайер А., Феро М., Карсунки Х., Саффрич Р., Морой Т., Ансорге В., Робертс Дж. И Эйлерс М. (2000). EMBO J. , 19 , 5813–5823.
Belenguer P, Baldin V, Mathieu C, Prats H, Bensaid M, Bouche G и Amalric F. (1989). Nucleic Acids Res. , 17, , 6625–6636.
Boon K, Caron HN, van Asperen R, Valentijn L, Hermus M-C, van Sluis P, Roobeek I, Weis I, Voute PA, Schwab M и Versteeg R.(2001). EMBO J. , 20 , 1383–1393.
Brandenburger Y, Jenkins A, Autelitano DJ и Hannan RD. (2001). FASEB J. , 15 , 2051–2053.
Brown TRP, Scott PH, Stein T, Winter AG и White RJ. (2000). Gene Expr. , 9 , 15–28.
Баллок А.Н., Хенкель Дж. И Фершт А.Р. (2000). Онкоген , 19 , 1245–1256.
Busch H и Smetana K.(1970). The Nucleolus , Busch H, Smetana K. (eds). Academic Press: New York, pp 448–471.
Google ученый
Кэрнс Калифорния и Уайт Р. Дж. (1998). EMBO J. , 17 , 3112–3123.
Дж. (1998). EMBO J. , 17 , 3112–3123.
Кавано А.Х., Хемпель В.М., Тейлор Л.Дж., Рогальский В., Тодоров Г. и Ротблюм Л.И. (1995). Nature , 374 , 177–180.
Чен В., Бокер В., Брозиус Дж. И Тидж Х.(1997a). J. Pathol. , 183 , 345–351.
Чен В., Хейерхорст Дж., Брозиус Дж. И Тидж Х. (1997b). Eur. J. Cancer , 33 , 288–292.
Чесноков И., Чу В.М., Ботчан М.Р. и Шмид С.В. (1996). Мол. Клетка. Биол. , 16, , 7084–7088.
Чу В.М., Ван З., Рёдер Р.Г. и Шмид С.В. (1997). J. Biol. Chem. , 272 , 14755–14761.
Сиарматори С., Скотт PH, Сатклифф Дж. Э., Маклис А., Альцухерри Х. М., Данненберг Дж. Х., Те Риле Х, Груммт I, Войт Р. и Уайт Р. Дж..(2001). Мол. Cell Biol. , 21, , 5806–5814.
Clarke PA, Schwemmle M, Schickinger J, Hilse K и Clemens MJ. (1991). Nucleic Acids Res. , 19 , 243–248.
, 19 , 243–248.
Клеменс М. (1992). Природа , 360 , 210–211.
Крайтон Д., Войвод А., Чжан С., Мандавиа Н., Мортон Дж. П., Варнок Л.Дж., Милнер Дж., Уайт Р.Дж. и Джонсон Д.Л. (2003). EMBO J. , 22 , 2810–2820.
Дейли Н.Л., Арванитис Д.А., Фэрли Дж. А., Гомес-Роман Н., Мортон Дж. П., Грэхем С. В., Спандидос Д. А. и Уайт Р. Дж.. Онкоген , Отправлено.
Дэвис М.В., Футрадо М., Херши Дж. Н., Тиммаппая Б. и Кауфман Р. Дж.. (1989). Proc. Natl. Акад. Sci. США , 86 , 9163–9167.
Деренцини М. и Плотон Д. (1994). Молекулярная биология в гистопатологии , Crocker J, (ed). Wiley and Sons Ltd: Нью-Йорк, стр. 231–249.
Google ученый
DiCiommo D, Gallie BL и Bremner R. (2000). Семин. Cancer Biol. , 10 , 255–269.
Вниз J. (2002). Nature Rev. Cancer , 3 , 11–22.
Cancer , 3 , 11–22.
Элиа А., Лэйнг К.Г., Скофилд А., Тиллерэ В.Дж. и Клеменс М.Дж. (1996). Nucleic Acids Res. , 24 , 4471–4478.
Фауст Р.А., Гапани М., Тристани П., Дэвис А., Адамс Г.Л. и Ахмед К.(1996). Cancer Lett. , 101 , 31–35.
Фелтон-Эдкинс ZA, Fairley JA, Graham EL, Johnston IM, White RJ и Scott PH. (2003a). EMBO J. , 22 , 2422–2432.
Фелтон-Эдкинс З.А., Кеннет Н.С., Браун TRP, Дейли Н.Л., Гомес-Роман Н., Грандори С., Эйзенман Р.Н. и Уайт Р.Дж. (2003b). Cell Cycle , 3 , 181–184.
Фелтон-Эдкинс З.А. и Уайт Р.Дж. (2002). J. Biol.Chem. , 277 , 48182–48191.
Francis MA и Rajbhandary UL. (1990). Мол. Cell Biol. , 10 , 4486–4494.
Гейдушек Е.П., Кассаветис Г.А. (2001). J. Mol. Биол. , 310 , 1-26.
Гавидель А. и Шульц М. С. (1997). Genes Dev. , 11 , 2780–2789.
С. (1997). Genes Dev. , 11 , 2780–2789.
Гавидель А. и Шульц М.С. (2001). Ячейка , 106 , 575–584.
Гомес-Роман Н., Грандори С., Эйзенман Р. Н. и Уайт Р. Дж. (2003). Nature , 421 , 290–294.
Gottesfeld JM, Johnson DL и Nyborg JK. (1996). Мол. Cell Biol. , 16, , 1777–1785.
Грана Х, Гаррига Дж. И Майол Х. (1998). Онкоген , 17 , 3365–3383.
Ханнан К.М., Ханнан Р.Д., Смит С.Д., Джефферсон Л.С., Лун М. и Ротблюм Л.И. (2000a). Онкоген , 19 , 4988–4999.
Ханнан К.М., Кеннеди Б.К., Кавано А.Х., Ханнан Р.Д., Хиршлер-Ласкевич I, Джефферсон Л.С. и Ротблюм Л.И. (2000b). Онкоген , 19 , 3487–3497.
Ханнан Р.Д., Хемпель В.М., Кавано А., Арино Т., Димитров С.И., Мосс Т. и Ротблюм Л.И. (1998). J. Biol. Chem. , 273 , 1257–1267.
Гавань JW. (1998). Ophthamology , 105 , 1442–1447.
(1998). Ophthamology , 105 , 1442–1447.
Эрнандес Н. (1993). Genes Dev. , 7 , 1291–1308.
Hirama T и Koeffler HP. (1995). Кровь , 86 , 841–854.
Hirsch HA, Gu L и Henry RW. (2000). Мол. Cell Biol. , 20, , 9182–9191.
Hockman DJ и Schultz MC. (1996). Мол. Cell Biol. , 16 , 892–898.
Hoeffler WK, Kovelman R и Roeder RG.(1988). Ячейка , 53 , 907–920.
Hoeffler WK и Roeder RG. (1985). Ячейка , 41 , 955–963.
Холлштейн М., Райс К., Гринблатт М.С., Сусси Т., Трахает Р., Сорли Т., Ховиг Е., Смит-Соренсен Б., Монтесано Р. и Харрис К.С. (1994). Nucleic Acids Res. , 22 , 3551–3555.
Хуан Р., Ву Т, Сюй Л., Лю А., Цзи И и Ху Г. (2002). FASEB J. , 16 , 293–301.
Хантер Т и Пайнс Дж. (1994). Ячейка , 79 , 573–582.
Джонсон Л.Ф., Абельсон Х.Т., Грин Х. и Пенман С. (1974). Ячейка , 1 , 95–100.
Johnson SAS, Dubeau L, Kawalek M, Dervan A, Schonthal AH, Dang CV и Johnson DL. (2003). Мол. Cell Biol. , 23 , 3043–3051.
Johnson SAS, Mandavia N, Wang H-D и Johnson DL. (2000). Мол.Cell Biol. , 20 , 5000–5009.
Johnston IM, Allison SJ, Morton JP, Schramm L, Scott PH и White RJ. (2002). Мол. Cell Biol. , 22 , 3757–3768.
King RJB. (1996). Cancer Biol. . Лонгман: Нью-Йорк, стр 27–32.
Google ученый
Китагава Н., Гото М., Куродзуми К., Маруо С., Фукаяма М., Наое Т., Ясукава М., Хино К., Судзуки Т., Тодо С. и Такада К..(2000). EMBO J. , 19 , 6742–6750.
Кляйн Дж. И Груммт И. (1999). Proc. Natl. Акад. Sci. США , 96 , 6096–6101.
Комано Дж. , Маруо С., Куродзуми К., Ода Т. и Такада К.. (1999). J. Virol. , 73 , 9827–9831.
, Маруо С., Куродзуми К., Ода Т. и Такада К.. (1999). J. Virol. , 73 , 9827–9831.
Коромилас А.Е., Рой С., Барбер Г.Н., Катце М.Г. и Соненберг Н. (1992). Science , 257 , 1685–1689.
Кратцке Р.А., Оттерсон Г.А., Хогг А., Коксон А.Б., Герадтс Дж., Коуэлл Дж.К. и Кей Ф.Дж.(1994). Онкоген , 9 , 1321–1326.
Курата С., Кога К. и Сакагути Б. (1978). Хромосома , 68 , 313–317.
Laing KG, Matys V и Clemens MJ. (1995). Biochem. Soc. Пер. , 23 , 311С.
Larminie CGC, Кэрнс, Калифорния, Митал Р., Мартин К., Кузаридес Т., Джексон С.П. и Уайт Р.Дж. (1997). EMBO J. , 16 , 2061–2071.
Larminie CGC, Sutcliffe JE, Tosh K, Winter AG, Felton-Edkins ZA и White RJ.(1999). Мол. Cell Biol. , 19, , 4927–4934.
Lengyel P. (1993). Proc. Natl. Акад. Sci. США , 90 , 5893–5895.
Либхабер С.А., Вольф С. и Шлессингер Д. (1978). Ячейка , 13 , 121–127.
Литчфилд Д.В. и Люшер Б. (1993). Мол. Клетка. Biochem. , 127/128 , 187–199.
Матеяк М.К., Обая А.Дж., Адачи С. и Седивий Ю.М.(1997). Cell Growth Differ. , 8 , 1039–1048.
Маук Дж. К. и Грин Х. (1974). Ячейка , 3 , 171–177.
Meurs EF, Galabru J, Barber GN, Katze MG и Hovanessian AG. (1993). Proc. Natl. Акад. Sci. США , 90 , 232–236.
Мосс Т., Стефановский В.Ю. (1995). Prog. Nucleic Acid Res. Мол. Биол. , 50 , 25–66.
Маллиган Дж. И Джекс Т.(1998). Trends Genet. , 14 , 223–229.
Munstermann U, Fritz G, Seitz G, Lu YP, Schneider HR и Issinger OG. (1990). Eur. J. Biochem. , 189 , 251–257.
Нанбо А., Иноуэ К., Адачи-Такасава К. и Такада К.. (2002). EMBO J. , 21 , 954–965.
и Такада К.. (2002). EMBO J. , 21 , 954–965.
Нэсмит К. (1996). Nature , 382 , 28–29.
Несбит CE, Терсак JM и Prochownik EV.(1999). Онкоген , 18 , 3004–3016.
Neufeld TP, de la Cruz AF, Johnston LA и Edgar BA. (1998). Ячейка , 93 , 1183–1193.
Нойфельд Т.П. и Эдгар Б.А. (1998). Curr. Opin. Cell Biol. , 10 , 784–790.
Notterman DA, Alon U, Sierk AJ и Levine AJ. (2001). Cancer Res. , 61, , 3124–3130.
Орен М. (1999). J. Biol. Chem. , 274 , 36031–36034.
Pelletier G, Stefanovsky VY, Faubladier M, Hirschler-Laszkiewicz I, Savard J, Rothblum LI, Cote J and Moss T. (2000). Мол. Ячейка , 6, , 1059–1066.
Пианезе Г. (1896 г.). Beitr. Патол. Анат. Allgem. Патол. , 142 , 1–193.
Помбо А. , Джексон Д.А., Холлинсхед М., Ван З., Родер Р.Г. и Кук П.Р. (1999). EMBO J., 18 , 2241–2253.
, Джексон Д.А., Холлинсхед М., Ван З., Родер Р.Г. и Кук П.Р. (1999). EMBO J., 18 , 2241–2253.
Рокко Ю.В. и Сидранский Д. (2001). Exp. Cell Res. , 264 , 42–55.
Руф И.К., Райн П.В., Ян К., Кливленд Дж. Л. и Сэмпл Дж. Т.. (2000). J. Virol. , 74 , 10223–10228.
Руджеро Д. и Пандольфи П.П. (2003). Nature Rev. Cancer , 3 , 179–192.
Шрамм Л. и Эрнандес Н. (2002). Genes Dev., 16, , 2593–2620.
Schwartz LB, Sklar VEF, Jaehning SJ, Weinmann R и Roeder RG. (1974). J. Biol. Chem. , 249 , 5889–5897.
Скотт MRD, Westphal KH и Rigby PWJ. (1983). Ячейка , 34 , 557–567.
Scott PH, Cairns CA, Sutcliffe JE, Alzuherri HM, Mclees A, Winter AG и White RJ. (2001). J. Biol. Chem. , 276 , 1005–1014.
Селдин Д.К. и Ледер П.(1995). Science , 267 , 894–897.
Продавцы WR, Novitch BG, Miyake S, Heith A, Otterson GA, Kaye FJ, Lassar AB и Kaelin WG. (1998). Genes Dev. , 12, , 95–106.
Sharp TV, Schwemmle M, Jeffrey I, Laing K, Mellor H, Proud CG, Hilse K и Clemens MJ. (1993). Nucleic Acids Res. , 21, , 4483–4490.
Шерр С.Дж. (2001). Nat. Rev. Mol. Клетка. Биол., 2 , 731–737.
Стефановский В.Ю., Пеллетье Г., Ханнан Р., Ганьон-Куглер Т., Ротблюм Л.И. и Мосс Т. (2001). Мол. Клетка. , 8 , 1063–1073.
Стейн Т., Крайтон Д., Бойл Дж. М., Варлей Дж. М. и Уайт Р. Дж. (2002a). Онкоген , 21 , 2961–2970.
Стейн Т., Крайтон Д., Уорнок Л.Дж., Милнер Дж. И Уайт Р.Дж. (2002b). Онкоген , 21 , 5540–5547.
Sugimoto M, Kuo M-L, Roussel MF и Sherr CJ.(2003). Мол. Ячейка , 11 , 415–424.
Sutcliffe JE. (2000). Кандидатская диссертация. Университет Глазго.
Кандидатская диссертация. Университет Глазго.
Сатклифф Дж. Э., Браун TRP, Эллисон С. Дж., Скотт PH и Уайт Р. Дж. (2000). Мол. Cell Biol. , 20, , 9192–9202.
Сатклифф Дж. Э., Кэрнс, Калифорния, Маклис А., Эллисон С. Дж., Тош К. и Уайт Р. Дж.. (1999). Мол. Cell Biol. , 19, , 4255–4261.
Тиммаппая Б., Вайнбергер С., Шнайдер Р.Дж. и Шенк Т.(1982). Ячейка , 31, , 543–551.
Войт Р. и Груммт И. (2001). Proc. Natl. Акад. Sci. США , 98 , 13631–13636.
Войт Р., Кун А., Сандер Э. и Груммт И. (1995). Nucleic Acids Res. , 23 , 2593–2599.
Войт Р., Шафер К. и Груммт И. (1997). Мол. Cell Biol. , 17, , 4230–4237.
Войт Р., Шнапп А, Кун А., Розенбауэр Х., Хиршманн П., Штунненберг Х.Г. и Груммт И.(1992). EMBO J. , 11 , 2211–2218.
Vousden KH. (1995). Семин. Cancer Biol. , 6 , 109–116.
Семин. Cancer Biol. , 6 , 109–116.
Ван, Х. Д., Триведи А. и Джонсон Д. Л.. (1997). Мол. Cell Biol. , 17, , 6838–6846.
Ван, Х. Д., Триведи А. и Джонсон Д. Л.. (1998). Мол. Cell Biol. , 18 , 7086–7094.
Ван Х-Д, Ю Ч-Х, Данг К.В. и Джонсон Д.Л.(1995). Мол. Cell Biol. , 15, , 6720–6728.
Warner JR. (1999). Trends Biochem. Sci. , 24 , 437–440.
Weinberg RA. (1995). Ячейка , 81 , 323–330.
Whitaker LL, Su H, Baskaran R, Knudsen ES и Wang JYJ. (1998). Мол. Клетка. Биол. , 18 , 4032–4042.
Белый RJ. (1997). Trends Biochem. Sci., 22 , 77–80.
Белый RJ. (2002). Landes Bioscience, Остин http://www.eurekah.com.
Белый RJ. (2004). In Cell Growth Control , (eds) Hall M, Raff M. и Thomas G. Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York.
Cold Spring Harbor Laboratory Press: Cold Spring Harbor, New York.
Google ученый
White RJ, Gottlieb TM, Downes CS и Jackson SP. (1995). Мол. Cell Biol., 15, , 6653–6662.
Белый RJ, Stott D и Rigby PWJ. (1990). EMBO J. , 9 , 3713–3721.
White RJ, Trouche D, Martin K, Jackson SP и Kouzarides T. (1996). Nature , 382 , 88–90.
Winter AG, Sourvinos G, Allison SJ, Tosh K, Scott PH, Spandidos DA и White RJ. (2000). Proc. Natl. Акад. Sci. США , 97 , 12619–12624.
Ямамото Н., Такидзава Т., Иванага Ю., Симидзу Н. и Ямамото Н.(2000). FEBS Lett. , 484 , 153–158.
Инь С., Грегг Д.В. и Горски Дж. (1996). Мол. Клеточный эндокринол. , 118 , 207–213.
Йошинага С., Дин Н., Хан М. и Берк А.Дж. (1986). EMBO J. , 5 , 343–354.
Чжай В. и Комай Л. (1999). Мол. Cell Biol. , 19 , 2791–2802.
Чжай В. и Комай Л. (2000). Мол.Cell Biol. , 20, , 5930–5938.
Чжао Дж., Юань Х, Фродин М. и Груммт И. (2003). Мол. Ячейка , 11, , 405–413.
zur Hausen H. (2000). J. Nat. Cancer Inst. , 92 , 690–698.
zur Hausen H. (2002). Nat. Rev Cancer , 2 , 342–350.
Нарушение регуляции транскрипции РНК-полимеразы III в эпителии шейки матки в ответ на вирус папилломы человека высокого риска
Интеграция HPV16 повышает экспрессию транскриптов pol III
После инфицирования слизистой оболочки аногенитальной области геном HPV первоначально сохраняется как эписом, но интеграция вирусной ДНК в хромосомы хозяина часто сопровождает злокачественное прогрессирование (Boshart et al., 1984; Schwarz et al., 1985; Алазави и др., 2002). Эта интеграция приводит к повышенной экспрессии как E6, так и E7 (Jeon et al. , 1995a; 1995b; Alazawi et al., 2002). W12 представляет собой линию кератиноцитов шейки матки человека, инфицированных ВПЧ16, которые были получены из поражения плоскоклеточного эпителия; сравнивали согласованные субклоны, несущие либо эписомальные, либо интегрированные копии вирусной ДНК. Мы использовали RT – PCR, чтобы проверить, связана ли интеграция HPV16 с изменениями экспрессии транскриптов pol III в модельной системе W12 (рис. 1).Было обнаружено, что ряд продуктов pol III сверхэкспрессируется в двух субклонах, несущих интегрированный HPV16 (дорожки 2 и 3), по сравнению с подобранными клетками, в которых вирусный геном остается эписомальным (дорожка 1). Таким образом, в интегрированных линиях W12G и W12GPXY наблюдалось повышение тРНК Arg , тРНК Leu , уникальной тРНК селеноцистеина (тРНК Sec ), 5S рРНК, MRP РНК, которая необходима как для митохондриальной репликации, так и для процессинг большой рРНК (Clayton, 2001) и 7SK РНК, которая регулирует фактор элонгации транскрипции pol II P-TEFb (Nguyen et al.
, 1995a; 1995b; Alazawi et al., 2002). W12 представляет собой линию кератиноцитов шейки матки человека, инфицированных ВПЧ16, которые были получены из поражения плоскоклеточного эпителия; сравнивали согласованные субклоны, несущие либо эписомальные, либо интегрированные копии вирусной ДНК. Мы использовали RT – PCR, чтобы проверить, связана ли интеграция HPV16 с изменениями экспрессии транскриптов pol III в модельной системе W12 (рис. 1).Было обнаружено, что ряд продуктов pol III сверхэкспрессируется в двух субклонах, несущих интегрированный HPV16 (дорожки 2 и 3), по сравнению с подобранными клетками, в которых вирусный геном остается эписомальным (дорожка 1). Таким образом, в интегрированных линиях W12G и W12GPXY наблюдалось повышение тРНК Arg , тРНК Leu , уникальной тРНК селеноцистеина (тРНК Sec ), 5S рРНК, MRP РНК, которая необходима как для митохондриальной репликации, так и для процессинг большой рРНК (Clayton, 2001) и 7SK РНК, которая регулирует фактор элонгации транскрипции pol II P-TEFb (Nguyen et al. , 2001, Ян и др., 2001). Хотя каждый протестированный транскрипт pol III в некоторой степени индуцировался в клетках с вирусной интеграцией, эффект проявляет специфичность, поскольку он не наблюдается с мРНК, полученной из pol II, кодирующей кислый рибосомный фосфопротеин P0 (ARPP P0). Для тРНК Leu и тРНК Arg , которые содержат интроны, наши праймеры ОТ-ПЦР обнаруживают короткоживущий первичный транскрипт, который считается надежным индикатором продолжающейся транскрипции из-за его быстрого преобразования в зрелую тРНК (Winter et al. al., 2000). Во всех остальных случаях измеряли стационарные уровни РНК. Эти данные предполагают специфическое повышение экспрессии pol III-зависимого гена, когда HPV16 интегрируется в геном клеток шейки матки, событие, часто связанное со злокачественным прогрессированием.
, 2001, Ян и др., 2001). Хотя каждый протестированный транскрипт pol III в некоторой степени индуцировался в клетках с вирусной интеграцией, эффект проявляет специфичность, поскольку он не наблюдается с мРНК, полученной из pol II, кодирующей кислый рибосомный фосфопротеин P0 (ARPP P0). Для тРНК Leu и тРНК Arg , которые содержат интроны, наши праймеры ОТ-ПЦР обнаруживают короткоживущий первичный транскрипт, который считается надежным индикатором продолжающейся транскрипции из-за его быстрого преобразования в зрелую тРНК (Winter et al. al., 2000). Во всех остальных случаях измеряли стационарные уровни РНК. Эти данные предполагают специфическое повышение экспрессии pol III-зависимого гена, когда HPV16 интегрируется в геном клеток шейки матки, событие, часто связанное со злокачественным прогрессированием.
Уровни транскрипта Pol III повышены в клетках W12 со встроенным HPV16. Специфические праймеры для указанных транскриптов были использованы для ПЦР-амплификации кДНК, полученных путем обратной транскрипции 2 мкг г РНК из клеток W12 с эписомальной (W12E; дорожка 1) или интегрированной ДНК HPV16 (W12G и W12GPXY; дорожки 2 и 3, соответственно. )
)
Биоптаты шейки матки, инфицированные HPV16, выражают повышенные уровни тРНК и 5S рРНК.
Анализ ОТ-ПЦР также использовался для проверки уровней транскриптов pol III в образцах биопсии шейки матки, которые были протестированы на статус ВПЧ.Первоначально мы исследовали семь биопсий, которые дали положительный результат на ВПЧ16, и три, в которых ВПЧ не был обнаружен. Экспрессия 5S рРНК, тРНК Arg и тРНК Sec была значительно повышена в каждом из образцов, содержащих HPV16, по сравнению с HPV-отрицательными биопсиями (рис. 2a). Первичные транскрипты генов тРНК Leu также наиболее сильно экспрессировались в образцах, положительных по ВПЧ16, хотя было перекрытие между уровнями в наиболее активных биоптатах, отрицательных по ВПЧ (образцы 8 и 9), и в наименее активных биоптатах, положительных на ВПЧ16 ( образцы 1 и 2).Эти вариации не отражают дифференциальную экстракцию или целостность РНК, поскольку они не проявляются в контроле мРНК ARPP P0, полученной из pol II. В отличие от других биопсий на рис. 2а, геном ВПЧ в образце 1 остался эписомальным и не смог интегрироваться. Таким образом, более низкая экспрессия тРНК и 5S рРНК в этой биопсии согласуется с нашими результатами, полученными на модели W12, которые предполагают, что активность pol III может быть усилена за счет интеграции HPV16.
В отличие от других биопсий на рис. 2а, геном ВПЧ в образце 1 остался эписомальным и не смог интегрироваться. Таким образом, более низкая экспрессия тРНК и 5S рРНК в этой биопсии согласуется с нашими результатами, полученными на модели W12, которые предполагают, что активность pol III может быть усилена за счет интеграции HPV16.
Присутствие интегрированной ДНК HPV16 в биоптатах человека коррелирует с повышенной экспрессией тРНК и 5S рРНК.кДНК, полученные путем обратной транскрипции 2 мкг г РНК из указанных образцов биопсии, амплифицировали с помощью ПЦР с использованием специфических праймеров для указанных транскриптов
. HPV16-положительные образцы также сравнивали с тремя биопсиями, содержащими HPV33 или HPV11. ВПЧ 33 реже связан с опухолями, чем ВПЧ 16, хотя он все еще считается типом высокого риска, тогда как ВПЧ 11 классифицируется как тип низкого риска (zur Hausen, 2002). Для 5S рРНК и каждой из исследованных тРНК экспрессия была значительно выше в биоптатах с HPV16 по сравнению с другими образцами (рис. 2b).Это может отражать различия между вирусными типами и / или тот факт, что вирус не смог интегрироваться в двух HPV33-положительных образцах.
2b).Это может отражать различия между вирусными типами и / или тот факт, что вирус не смог интегрироваться в двух HPV33-положительных образцах.
Совершенно разные паттерны экспрессии наблюдались для 7SK и MRP РНК. В то время как первое оставалось относительно постоянным, второе заметно варьировалось между образцами, но не таким образом, который коррелировал со статусом HPV или экспрессией тРНК (рис. 2a и b). Однако оба этих транскрипта показали резкое увеличение в одной HPV11-положительной опухоли (биопсия 14).
Вариабельная экспрессия мРНК, кодирующих TFIIIC2 и TFIIIB, в клетках шейки матки
Различный ответ 7SK и MRP может отражать их очень отличное расположение промоторов от такового для генов 5S рРНК и тРНК. Таким образом, последовательности перед сайтом инициации необходимы и достаточны для транскрипции генов 7SK и MRP, в отличие от внутренних промоторов, обнаруженных в большинстве матриц pol III (Murphy et al., 1987; Yuan and Reddy, 1991). Это приводит к определенным требованиям к факторам (рассмотрено Гейдушеком и Кассаветисом, 2001; Шрамм и Эрнандес, 2002). Например, TFIIIC2 необходим для экспрессии тРНК и 5S рРНК, но не используется такими генами, как 7SK, которые лишены внутренних промоторов (Geiduschek and Kassavetis, 2001; Schramm and Hernandez, 2002; White, 2002). Поэтому мы исследовали, может ли экспрессия TFIIIC2 отвечать на ВПЧ. ОТ-ПЦР использовалась для сравнения в 10 биоптатах шейки матки относительных уровней мРНК, кодирующих пять субъединиц TFIIIC2 (рис. 3). Было обнаружено, что экспрессия этих мРНК существенно различается в разных образцах. Причина этой изменчивости в настоящее время неясна, но она не коррелирует со статусом ВПЧ.Соответственно, мы не нашли доказательств того, что гены TFIIIC2 индуцируются в ответ на интеграцию HPV16 в клетках W12 (данные не показаны). Более того, нет корреляции между относительными уровнями этих мРНК и экспрессией транскрипта pol III. Эти данные предполагают, что TFIIIC2 не может быть ограничивающим для этого типа клеток и что HPV16 не индуцирует экспрессию генов TFIIIC2.
Например, TFIIIC2 необходим для экспрессии тРНК и 5S рРНК, но не используется такими генами, как 7SK, которые лишены внутренних промоторов (Geiduschek and Kassavetis, 2001; Schramm and Hernandez, 2002; White, 2002). Поэтому мы исследовали, может ли экспрессия TFIIIC2 отвечать на ВПЧ. ОТ-ПЦР использовалась для сравнения в 10 биоптатах шейки матки относительных уровней мРНК, кодирующих пять субъединиц TFIIIC2 (рис. 3). Было обнаружено, что экспрессия этих мРНК существенно различается в разных образцах. Причина этой изменчивости в настоящее время неясна, но она не коррелирует со статусом ВПЧ.Соответственно, мы не нашли доказательств того, что гены TFIIIC2 индуцируются в ответ на интеграцию HPV16 в клетках W12 (данные не показаны). Более того, нет корреляции между относительными уровнями этих мРНК и экспрессией транскрипта pol III. Эти данные предполагают, что TFIIIC2 не может быть ограничивающим для этого типа клеток и что HPV16 не индуцирует экспрессию генов TFIIIC2.
Присутствие интегрированной ДНК HPV16 в биоптатах человека не коррелирует с каким-либо изменением экспрессии мРНК, кодирующих TFIIIC2. кДНК, полученные путем обратной транскрипции 2 мкг г РНК из указанных образцов биопсии, амплифицировали с помощью ПЦР с использованием специфических праймеров для указанных транскриптов.
кДНК, полученные путем обратной транскрипции 2 мкг г РНК из указанных образцов биопсии, амплифицировали с помощью ПЦР с использованием специфических праймеров для указанных транскриптов.
ОТ-ПЦР также использовали для анализа относительных уровней мРНК, кодирующих TFIIIB. Это комплекс, состоящий из трех субъединиц, TBP, Brf1 и Bdp1 (Geiduschek, Kassavetis, 2001; Schramm and Hernandez, 2002). Из них Bdp1 сильно индуцируется в фибробластах SV40 и полиомавирусом, тогда как TBP и Brf1 не реагируют на эти вирусы (Felton-Edkins and White, 2002).Напротив, мы не нашли доказательств того, что HPV16 индуцирует экспрессию Bdp1 в эпителии шейки матки (рис. 4a и b). Однако существенные различия в мРНК Bdp1 были обнаружены между образцами биопсии, включая резкое повышение в биопсии опухоли 14, инфицированной HPV11 (рис. 4b). Поразительно, что карцинома с особенно высоким уровнем мРНК Bdp1 также является опухолью, которая сверхэкспрессирует 7SK и MRP РНК (рис. 2а). Хотя это предполагает, что очень высокие уровни Bdp1 могут активировать транскрипцию генов 7SK и MRP, четкой корреляции между Bdp1, 7SK и MRP РНК в других образцах биопсии нет.
Анализ ОТ-ПЦР мРНК, кодирующих субъединицы TFIIIB, в биоптатах человека и клетках W12. ( a, b ) кДНК, полученные путем обратной транскрипции 2 мкг г РНК из указанных образцов биопсии, амплифицировали с помощью ПЦР с использованием специфических праймеров для указанных транскриптов. ( c ) кДНК, полученные путем обратной транскрипции 2 мкг г РНК из клеток W12 с эписомальной (дорожка 1) или интегрированной ДНК HPV16 (дорожки 2 и 3), амплифицировали с помощью ПЦР с использованием специфических праймеров для указанных транскриптов
Относительный уровни мРНК TBP также заметно варьировались между отдельными образцами биопсии, но опять же не было очевидной корреляции ни со статусом HPV, ни с экспрессией конкретных продуктов pol III (рис. 4a и b).Однако была обнаружена корреляция между обоими этими параметрами и относительными уровнями мРНК, кодирующей TFIIIB-специфичную субъединицу Brf1. Таким образом, экспрессия Brf1 была максимальной в биоптатах, которые показали самый высокий выход тРНК и 5S рРНК. Во всех случаях, кроме одного, это коррелировало с наличием ВПЧ16; исключением является образец 1, который показал небольшое повышение мРНК Brf1 или его отсутствие, а также самый низкий уровень тРНК среди HPV16-положительных биоптатов. В отличие от других биопсий, вирусный геном в образце 1 оказался эписомальным, а не интегрированным в ДНК клетки-хозяина.Это согласуется с нашими результатами модели W12, которые предполагают, что активность pol III усиливается за счет интеграции HPV16. Кроме того, это повысило вероятность того, что интеграция вируса может также стимулировать экспрессию Brf1. Чтобы проверить это, мы исследовали, содержат ли клетки W12 со встроенным HPV16 более высокие уровни мРНК Brf1, чем клетки W12, в которых вирусный геном остается эписомальным; это действительно имело место (рис. 4c).
Во всех случаях, кроме одного, это коррелировало с наличием ВПЧ16; исключением является образец 1, который показал небольшое повышение мРНК Brf1 или его отсутствие, а также самый низкий уровень тРНК среди HPV16-положительных биоптатов. В отличие от других биопсий, вирусный геном в образце 1 оказался эписомальным, а не интегрированным в ДНК клетки-хозяина.Это согласуется с нашими результатами модели W12, которые предполагают, что активность pol III усиливается за счет интеграции HPV16. Кроме того, это повысило вероятность того, что интеграция вируса может также стимулировать экспрессию Brf1. Чтобы проверить это, мы исследовали, содержат ли клетки W12 со встроенным HPV16 более высокие уровни мРНК Brf1, чем клетки W12, в которых вирусный геном остается эписомальным; это действительно имело место (рис. 4c).
Инактивация RB или p53 не увеличивает экспрессию мРНК Brf1
Было показано, что интеграция вирусов стимулирует экспрессию E6 и E7.Соответственно, анализ уровней мРНК E7 с использованием праймеров, специфичных для HPV16, выявил самую низкую экспрессию в образце 1, в котором вирус оставался эписомальным (рис. 5). Уровень мРНК E7 в этих образцах коррелирует с уровнем Brf1, причем образцы 3–6 показывают наивысшую экспрессию обоих. Это повышает вероятность того, что Brf1 может быть индуцирован с помощью E7, возможно, посредством инактивации RB или его родственников p107 и p130. Поэтому мы исследовали, реагирует ли экспрессия Brf1 на потерю семейства RB.С этой целью сравнивали уровни транскриптов из совпадающих эмбриональных фибробластов мышей дикого типа и мышей с нокаутом по RB. Хотя экспрессия гена тРНК явно повышена в клетках Rb — / — , как было продемонстрировано ранее (White et al., 1996; Scott et al., 2001), не наблюдалось увеличения мРНК Brf1 (Рисунок 6, дорожки 1 и 2). Точно так же фибробласты с тройным нокаутом (TKO) мышей Rb — / — p107 — / — p130 — / — демонстрируют повышенные уровни тРНК, но нормальные уровни мРНК Brf1 (фиг. 6, дорожки 3 и 4).Это предполагает, что повышенная экспрессия Brf1 в HPV16-позитивных опухолях вряд ли является результатом инактивации RB или его родственников.
5). Уровень мРНК E7 в этих образцах коррелирует с уровнем Brf1, причем образцы 3–6 показывают наивысшую экспрессию обоих. Это повышает вероятность того, что Brf1 может быть индуцирован с помощью E7, возможно, посредством инактивации RB или его родственников p107 и p130. Поэтому мы исследовали, реагирует ли экспрессия Brf1 на потерю семейства RB.С этой целью сравнивали уровни транскриптов из совпадающих эмбриональных фибробластов мышей дикого типа и мышей с нокаутом по RB. Хотя экспрессия гена тРНК явно повышена в клетках Rb — / — , как было продемонстрировано ранее (White et al., 1996; Scott et al., 2001), не наблюдалось увеличения мРНК Brf1 (Рисунок 6, дорожки 1 и 2). Точно так же фибробласты с тройным нокаутом (TKO) мышей Rb — / — p107 — / — p130 — / — демонстрируют повышенные уровни тРНК, но нормальные уровни мРНК Brf1 (фиг. 6, дорожки 3 и 4).Это предполагает, что повышенная экспрессия Brf1 в HPV16-позитивных опухолях вряд ли является результатом инактивации RB или его родственников. Мы применили аналогичный подход, чтобы проверить, вызван ли эффект E6-опосредованным удалением р53, путем сравнения экспрессии в согласованных эмбриональных фибробластах мышей дикого типа и мышей с нокаутом по р53. Опять же, уровни мРНК Brf1 оставались неизменными, хотя экспрессия тРНК повышалась в нокаутах (фиг. 6, дорожки 5 и 6), как было показано ранее ядерным анализом (Cairns and White, 1998).Синтез тРНК увеличивается в обоих наборах нокаутов, потому что RB и p53 связываются с TFIIIB, чтобы непосредственно репрессировать транскрипцию pol III (Cairns and White, 1998; Larminie et al., 1997). Однако экспрессия Brf1 в этих условиях, по-видимому, не меняется. Уровни мРНК Brf1 также не нарушены в линии остеосаркомы RB — / — p53 — / — SAOS2 по сравнению с клетками остеосаркомы U20S, которые содержат RB дикого типа и p53 (фиг. 6, дорожки 7 и 8). Поэтому кажется маловероятным, что E6-опосредованное удаление p53 или E7-опосредованная нейтрализация RB ответственны за повышенные уровни мРНК Brf1, наблюдаемые при HPV16-позитивных раковых опухолях.
Мы применили аналогичный подход, чтобы проверить, вызван ли эффект E6-опосредованным удалением р53, путем сравнения экспрессии в согласованных эмбриональных фибробластах мышей дикого типа и мышей с нокаутом по р53. Опять же, уровни мРНК Brf1 оставались неизменными, хотя экспрессия тРНК повышалась в нокаутах (фиг. 6, дорожки 5 и 6), как было показано ранее ядерным анализом (Cairns and White, 1998).Синтез тРНК увеличивается в обоих наборах нокаутов, потому что RB и p53 связываются с TFIIIB, чтобы непосредственно репрессировать транскрипцию pol III (Cairns and White, 1998; Larminie et al., 1997). Однако экспрессия Brf1 в этих условиях, по-видимому, не меняется. Уровни мРНК Brf1 также не нарушены в линии остеосаркомы RB — / — p53 — / — SAOS2 по сравнению с клетками остеосаркомы U20S, которые содержат RB дикого типа и p53 (фиг. 6, дорожки 7 и 8). Поэтому кажется маловероятным, что E6-опосредованное удаление p53 или E7-опосредованная нейтрализация RB ответственны за повышенные уровни мРНК Brf1, наблюдаемые при HPV16-позитивных раковых опухолях.
Сравнение экспрессии мРНК E7 в биоптатах шейки матки. кДНК, полученные путем обратной транскрипции 2 мкг г РНК из указанных образцов биопсии, амплифицировали с помощью ПЦР с использованием специфических праймеров для мРНК, кодирующей HPV16 E7 (верхняя полоса) и ARPP P0 (нижняя полоса)
Рисунок 6Экспрессия мРНК Brf1 не увеличивается в RB- или p53-нокаутированных фибробластах. кДНК были получены путем обратной транскрипции 2 мкг г РНК из эмбриональных фибробластов дикого типа (дорожки 1, 3 и 5), RB-нокаут (дорожка 2), RB, p107, p130 с тройным нокаутом (дорожка 4) или мышей с нокаутом р53 (дорожка 6), и из линий клеток остеосаркомы U2OS (дорожка 7) и SAOS2 (дорожка 8).Эти кДНК были амплифицированы с помощью ПЦР с использованием специфических праймеров для тРНК Leu , мРНК Brf1 и мРНК ARPP P0, как указано
Brf1 является ограничивающим фактором транскрипции pol III в клетках шейки матки
Корреляция, наблюдаемая в образцах биопсии между уровнями тРНК, 5S рРНК и мРНК Brf1 предполагают, что доступность Brf1 может ограничивать скорость транскрипции многих матриц pol III в эпителии шейки матки. Чтобы проверить это, мы исследовали, может ли повышение уровня Brf1 стимулировать транскрипцию генов тРНК и 5S рРНК в клетках шейки матки.Предыдущая работа показала, что транскрипция pol III заметно увеличивается при фазовом переходе G1 / S из-за заметного увеличения активности TFIIIB, когда он диссоциирует от RB и p130 (White et al., 1995b; Scott et al., 2001). Поэтому мы исследовали реакцию на Brf1 как в фазе G1, так и в фазе S. Клетки HeLa трансфицировали вектором экспрессии, кодирующим Brf1, а затем синхронизировали с использованием тимидиновых или нокодозольных блоков для остановки прогрессирования клеточного цикла; после освобождения от этих синхронизирующих блоков клетки собирали либо в ранней фазе G1, либо в S фазе.Как ранее было продемонстрировано с помощью ядерных анализов (White et al., 1995b), транскрипция pol III существенно менее активна перед переходом G1 / S (Рисунок 7). Трансфекция Brf1 оказала лишь незначительное влияние на способность клеток в S-фазе транскрибировать ген тРНК, но сильно стимулировала экспрессию в клетках с фазой G1 (фиг.
Чтобы проверить это, мы исследовали, может ли повышение уровня Brf1 стимулировать транскрипцию генов тРНК и 5S рРНК в клетках шейки матки.Предыдущая работа показала, что транскрипция pol III заметно увеличивается при фазовом переходе G1 / S из-за заметного увеличения активности TFIIIB, когда он диссоциирует от RB и p130 (White et al., 1995b; Scott et al., 2001). Поэтому мы исследовали реакцию на Brf1 как в фазе G1, так и в фазе S. Клетки HeLa трансфицировали вектором экспрессии, кодирующим Brf1, а затем синхронизировали с использованием тимидиновых или нокодозольных блоков для остановки прогрессирования клеточного цикла; после освобождения от этих синхронизирующих блоков клетки собирали либо в ранней фазе G1, либо в S фазе.Как ранее было продемонстрировано с помощью ядерных анализов (White et al., 1995b), транскрипция pol III существенно менее активна перед переходом G1 / S (Рисунок 7). Трансфекция Brf1 оказала лишь незначительное влияние на способность клеток в S-фазе транскрибировать ген тРНК, но сильно стимулировала экспрессию в клетках с фазой G1 (фиг.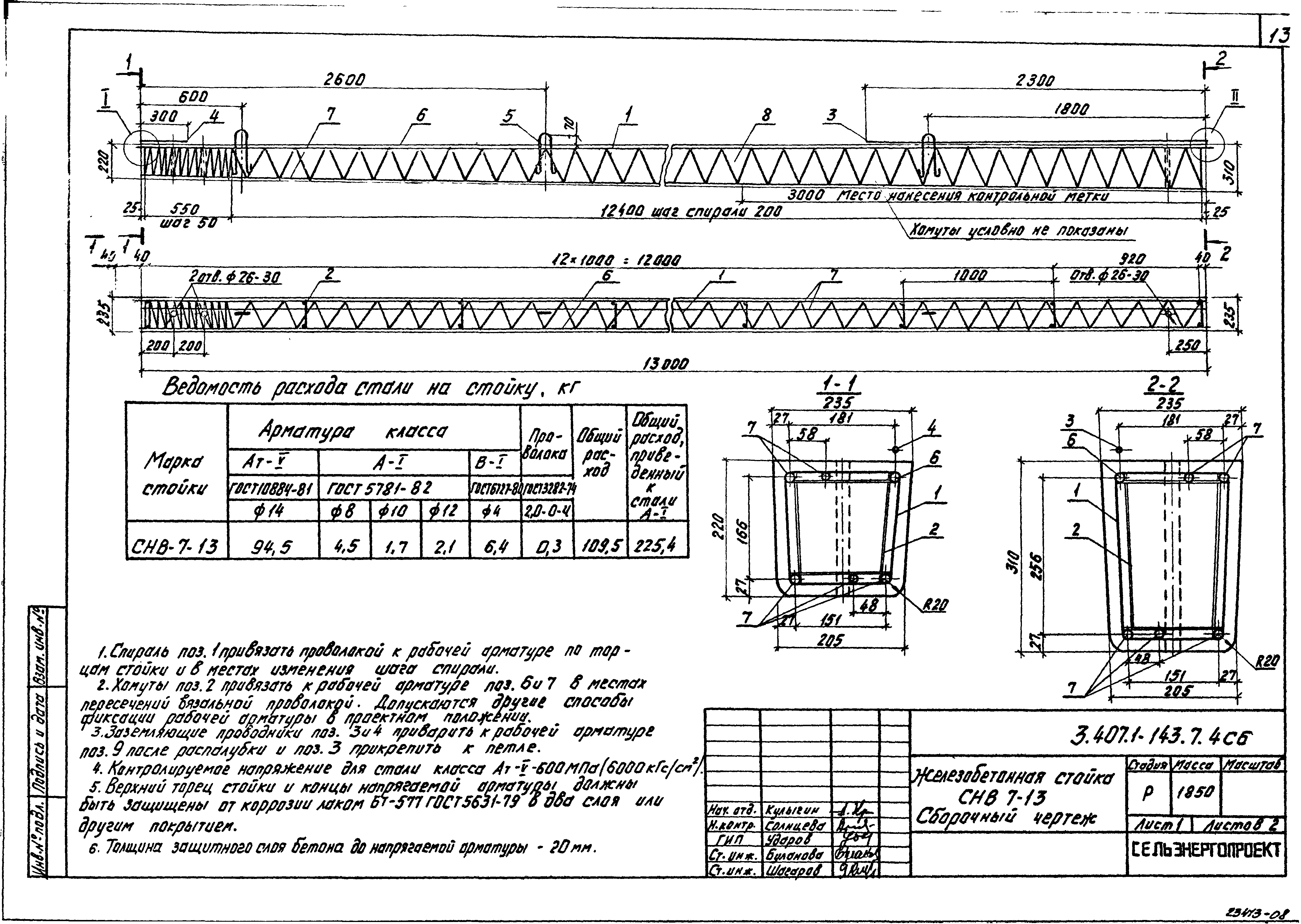 7a). Однако транскрипция гена 5S рРНК заметно увеличивалась с помощью Brf1 в клетках как в G1, так и в S фазе (рис. 7b). Напротив, транскрипция pol III гена 7SK не дала ответа в идентичных условиях (фиг. 7c), в соответствии с его отличной организацией промотора и требованиями к факторам (Schramm and Hernandez, 2002).Эти данные ясно свидетельствуют о том, что увеличение уровней Brf1 может избирательно стимулировать синтез тРНК и 5S рРНК в клетках шейки матки. Таким образом, они предлагают объяснение наблюдаемой корреляции в биоптатах шейки матки между уровнями этих продуктов pol III и мРНК Brf1.
7a). Однако транскрипция гена 5S рРНК заметно увеличивалась с помощью Brf1 в клетках как в G1, так и в S фазе (рис. 7b). Напротив, транскрипция pol III гена 7SK не дала ответа в идентичных условиях (фиг. 7c), в соответствии с его отличной организацией промотора и требованиями к факторам (Schramm and Hernandez, 2002).Эти данные ясно свидетельствуют о том, что увеличение уровней Brf1 может избирательно стимулировать синтез тРНК и 5S рРНК в клетках шейки матки. Таким образом, они предлагают объяснение наблюдаемой корреляции в биоптатах шейки матки между уровнями этих продуктов pol III и мРНК Brf1.
Повышение концентрации Brf1 в клетках шейки матки стимулирует транскрипцию pol III генов, кодирующих тРНК и 5S рРНК, но не 7SK РНК. ( a ) Транскрипция гена тРНК Leu с использованием 10 мкг г экстракта, полученного из клеток HeLa, трансфицированных пустым вектором (10 мкг г дорожек 1 и 4; 5 мкг г дорожек 2 и 5) и pcDNA3HA. BRF (5 мкм, г, дорожки 2 и 5; 10 мкм, г, дорожки 3 и 6). После трансфекции клетки синхронизировали в фазах S (дорожки 1–3) или G1 (дорожки 4–6) перед сбором. ( b ) Как указано выше, за исключением того, что ген 5S рРНК использовали в качестве матрицы транскрипции. ( c ) Транскрипция гена 7SK с использованием 10 мкг г экстракта, полученного из клеток HeLa, трансфицированных пустым вектором (дорожки 1 и 3), или 10 мкг мкг pcDNA3HA.BRF (дорожки 2 и 4). После трансфекции клетки синхронизировали в фазах G1 (дорожки 1 и 2) или S (дорожки 3 и 4) перед сбором
BRF (5 мкм, г, дорожки 2 и 5; 10 мкм, г, дорожки 3 и 6). После трансфекции клетки синхронизировали в фазах S (дорожки 1–3) или G1 (дорожки 4–6) перед сбором. ( b ) Как указано выше, за исключением того, что ген 5S рРНК использовали в качестве матрицы транскрипции. ( c ) Транскрипция гена 7SK с использованием 10 мкг г экстракта, полученного из клеток HeLa, трансфицированных пустым вектором (дорожки 1 и 3), или 10 мкг мкг pcDNA3HA.BRF (дорожки 2 и 4). После трансфекции клетки синхронизировали в фазах G1 (дорожки 1 и 2) или S (дорожки 3 и 4) перед сбором
Координация транскрипции и процессинга тРНК — Jarrous — — The FEBS Journal
Pol III, РНКаза P , и инициирующие комплексы I типа
Pol III транскрибирует большое количество генов небольших некодирующих РНК, кодирующих тРНК, 5S рРНК, SRP РНК, 7SK РНК, U6 snRNA, RMRP и RPPh2 [[51-56]].В клетках человека эта полимераза также транскрибирует тысячи элементов Alu, которые принадлежат к семейству ретротранспозонов с короткими вкраплениями ядер (SINE) и насчитывают ~ 1,2 миллиона копий, покрывающих примерно одну десятую генома [[57-59]]. Pol III имеет семнадцать белковых субъединиц [[60-62]], три из которых образуют специфический субкомплекс RPC3-RPC6-RPC7, участвующий в промотор-зависимой инициации и удлинении [[52, 62-67]]. Крио-ЭМ структура человеческого Pol III обнаруживает несколько видоспецифичных модулей, которые обеспечивают активацию и репрессию транскрипции [[64, 65, 68]].Основные факторы транскрипции TFIIIA, TFIIIB, TFIIIC и SNAPc собирают различные инициирующие комплексы Pol III на генах-мишенях с различными типами промоторов и вспомогательными цис-действующими последовательностями [[51, 53, 54, 61, 63, 69, 70]] . Исключительный фактор транскрипции, рибонуклеопротеиновая РНКаза P, имеет решающее значение для транскрипции генов человеческой тРНК, 5S рРНК, SRP РНК и U6 мяРНК в клетках и экстрактах (см. Ниже) [[71-73]], но не в системах минимального восстановления. [[74-76]], которые, как показано, требуют только TFIIIB или даже Pol III для полимеризации РНК [[74, 75]].
Pol III имеет семнадцать белковых субъединиц [[60-62]], три из которых образуют специфический субкомплекс RPC3-RPC6-RPC7, участвующий в промотор-зависимой инициации и удлинении [[52, 62-67]]. Крио-ЭМ структура человеческого Pol III обнаруживает несколько видоспецифичных модулей, которые обеспечивают активацию и репрессию транскрипции [[64, 65, 68]].Основные факторы транскрипции TFIIIA, TFIIIB, TFIIIC и SNAPc собирают различные инициирующие комплексы Pol III на генах-мишенях с различными типами промоторов и вспомогательными цис-действующими последовательностями [[51, 53, 54, 61, 63, 69, 70]] . Исключительный фактор транскрипции, рибонуклеопротеиновая РНКаза P, имеет решающее значение для транскрипции генов человеческой тРНК, 5S рРНК, SRP РНК и U6 мяРНК в клетках и экстрактах (см. Ниже) [[71-73]], но не в системах минимального восстановления. [[74-76]], которые, как показано, требуют только TFIIIB или даже Pol III для полимеризации РНК [[74, 75]].
Обширные анализы биохимической очистки ядерной РНКазы P из клеток HeLa демонстрируют, что она состоит из РНК h2 и многих белковых субъединиц, обозначенных Rpp14, Rpp20, Rpp21, Rpp25, Rpp29, Rpp30, Rpp38, Rpp40, Pop1 и Pop5 (Таблица 1) [ [5, 27, 77-79]]. За исключением Rpp21, остальные белковые субъединицы являются общими для RNase MRP, эволюционно родственного ядрышкового и митохондриального рибонуклеопротеина [[28, 31, 78-87]]. Выяснение третичной структуры высокоочищенной РНКазы HeLa P с помощью крио-ЭМ показывает, что каталитическая РНК h2 покрыта ее белковыми субъединицами, расположенными в трех субкомплексах: Rpp20-Rpp25, Pop5-Rpp14- (Rpp30) 2 -Rpp40, и Rpp21-Rpp29-Rpp38, и один полипептид Pop1 [[29]].Эти консервативные белки образуют взаимосвязанный зажим, который стабилизирует РНК h2 в конформации, которая делает возможным распознавание и расщепление 5′-лидера предшественника тРНК посредством механизма двойного якоря [[29]]. Следовательно, в клетке существует активный рибонуклеопротеин РНКазы P с набором из 10 белковых субъединиц [[5, 27]].
За исключением Rpp21, остальные белковые субъединицы являются общими для RNase MRP, эволюционно родственного ядрышкового и митохондриального рибонуклеопротеина [[28, 31, 78-87]]. Выяснение третичной структуры высокоочищенной РНКазы HeLa P с помощью крио-ЭМ показывает, что каталитическая РНК h2 покрыта ее белковыми субъединицами, расположенными в трех субкомплексах: Rpp20-Rpp25, Pop5-Rpp14- (Rpp30) 2 -Rpp40, и Rpp21-Rpp29-Rpp38, и один полипептид Pop1 [[29]].Эти консервативные белки образуют взаимосвязанный зажим, который стабилизирует РНК h2 в конформации, которая делает возможным распознавание и расщепление 5′-лидера предшественника тРНК посредством механизма двойного якоря [[29]]. Следовательно, в клетке существует активный рибонуклеопротеин РНКазы P с набором из 10 белковых субъединиц [[5, 27]].
Исследования клеточной биологии показывают, что РНК h2 преимущественно локализована в нуклеоплазме и ядрышках клеток человека [[88-90]]. Сходные субядерные распределения описаны для белковых субъединиц РНКазы P [[91]]. Однако, поскольку эти белковые субъединицы являются общими с РНКазой MRP, трудно определить точное местоположение РНКазы P [[92]]. Фактически, дрожжевые гомологи Pop1, Rpp20 и Rpp25 также разделяются третьим рибонуклеопротеином, теломеразой [[93-95]]. Эти три белка необходимы для стабильности и транспорта компонента теломеразной РНК (TERC) из цитоплазмы в ядро [[93, 94]]. Человеческие Rpp20 и Rpp25 образуют гетеродимер и кооперативно связываются с РНК h2 в домене P3 [[95]], консервативной шпильке-подобной структуре, участвующей в ядерной локализации РНК h2, РНК RMRP и TERC [[93-96] ]].h2 РНК также существует в ядрышке и цитоплазме, возможно, подвергаясь предварительной сборке или выполняя различные задачи в этих компартментах [[97]]. Специфическая субъединица Rpp21 находится скорее в нуклеоплазме [[98]], на рабочем месте Pol III в транскрипции генов тРНК [[99]]. Эти исследования показывают, что РНКаза P присутствует в различных формах или действует в нескольких местах клетки (см. Ниже) [[92]]
Однако, поскольку эти белковые субъединицы являются общими с РНКазой MRP, трудно определить точное местоположение РНКазы P [[92]]. Фактически, дрожжевые гомологи Pop1, Rpp20 и Rpp25 также разделяются третьим рибонуклеопротеином, теломеразой [[93-95]]. Эти три белка необходимы для стабильности и транспорта компонента теломеразной РНК (TERC) из цитоплазмы в ядро [[93, 94]]. Человеческие Rpp20 и Rpp25 образуют гетеродимер и кооперативно связываются с РНК h2 в домене P3 [[95]], консервативной шпильке-подобной структуре, участвующей в ядерной локализации РНК h2, РНК RMRP и TERC [[93-96] ]].h2 РНК также существует в ядрышке и цитоплазме, возможно, подвергаясь предварительной сборке или выполняя различные задачи в этих компартментах [[97]]. Специфическая субъединица Rpp21 находится скорее в нуклеоплазме [[98]], на рабочем месте Pol III в транскрипции генов тРНК [[99]]. Эти исследования показывают, что РНКаза P присутствует в различных формах или действует в нескольких местах клетки (см. Ниже) [[92]]
Помимо своей классической роли в процессинге 5′-лидера тРНК-предшественника, человеческая РНКаза P участвует в транскрипции гена малой некодирующей РНК с помощью Pol III. Эксперименты по коиммунопреципитации демонстрируют, что моноклональные антитела, направленные против специфических и основных белковых субъединиц Pol III, снижают активную РНКазу P из экстрактов цельных клеток [[72]]. Белковые субъединицы РНКазы P и Pol III связываются с транскрипционно активными локусами генов 5S рРНК и тРНК зависимым от клеточного цикла образом, как показали анализы иммунопреципитации хроматина [[72, 97]]. Нокдаун экспрессии белковых субъединиц РНКазы P посредством РНК-интерференции серьезно ингибирует транскрипцию генов 5S рРНК, тРНК, SRP РНК и U6 мяРНК в клетках и экстрактах [[72, 73, 97]].Степень ингибирования транскрипции пропорциональна эффективности нокдауна. Более того, нокдаун РНКазы P приводит к снижению связывания RPC6 и RPC7 с локусами генов 5S рРНК и тРНК [[73]]. Это открытие подчеркивает необходимость интактной РНКазы P в формировании инициирующего субкомплекса, который расположен близко к начальной точке транскрипции [[52, 66-68, 100]].
Эксперименты по коиммунопреципитации демонстрируют, что моноклональные антитела, направленные против специфических и основных белковых субъединиц Pol III, снижают активную РНКазу P из экстрактов цельных клеток [[72]]. Белковые субъединицы РНКазы P и Pol III связываются с транскрипционно активными локусами генов 5S рРНК и тРНК зависимым от клеточного цикла образом, как показали анализы иммунопреципитации хроматина [[72, 97]]. Нокдаун экспрессии белковых субъединиц РНКазы P посредством РНК-интерференции серьезно ингибирует транскрипцию генов 5S рРНК, тРНК, SRP РНК и U6 мяРНК в клетках и экстрактах [[72, 73, 97]].Степень ингибирования транскрипции пропорциональна эффективности нокдауна. Более того, нокдаун РНКазы P приводит к снижению связывания RPC6 и RPC7 с локусами генов 5S рРНК и тРНК [[73]]. Это открытие подчеркивает необходимость интактной РНКазы P в формировании инициирующего субкомплекса, который расположен близко к начальной точке транскрипции [[52, 66-68, 100]].
Очистка инициирующих комплексов, собранных на гене 5S рРНК человека с помощью гель-фильтрационной хроматографии и скоростной седиментации в градиенте глицерина, показывает, что эти сборки содержат активный рибонуклеопротеин РНКазы P (см. Ниже) [[73]].Эти инициирующие комплексы типа I имеют расчетную молекулярную массу 1,5–2 × 10 6 [[73]]. Однако РНКаза P не выполняет эндорибонуклеолитическую задачу в этих комплексах, которые требуют TFIIIA, TFIIIB и TFIIIC для транскрипции [[51, 60, 62, 63, 101]], поскольку возникающая 5S рРНК не подвергается сайт-специфическому расщеплению. . Примечательно, что нацеливание белковой субъединицы Rpp25 для разрушения посредством РНК-интерференции ингибирует транскрипцию гена 5S рРНК из-за сборки аберрантных инициирующих комплексов [[72, 97]].Rpp25 представляет собой альба-подобный связывающий хроматин белок, и он гетеродимеризуется с субъединицей Rpp20, АТФазой [[102]]. Следовательно, РНКаза P выполняет нетипичную роль в инициирующих комплексах, возможно, в модификации структуры и функции хроматина [[22, 73]]. Эта возможность подтверждается открытиями, что Rpp21, Rpp29 и Pop1 способны репрессировать дислокацию нуклеосом с помощью гистонового варианта h4.3 в клетках [[103, 104]].
Ниже) [[73]].Эти инициирующие комплексы типа I имеют расчетную молекулярную массу 1,5–2 × 10 6 [[73]]. Однако РНКаза P не выполняет эндорибонуклеолитическую задачу в этих комплексах, которые требуют TFIIIA, TFIIIB и TFIIIC для транскрипции [[51, 60, 62, 63, 101]], поскольку возникающая 5S рРНК не подвергается сайт-специфическому расщеплению. . Примечательно, что нацеливание белковой субъединицы Rpp25 для разрушения посредством РНК-интерференции ингибирует транскрипцию гена 5S рРНК из-за сборки аберрантных инициирующих комплексов [[72, 97]].Rpp25 представляет собой альба-подобный связывающий хроматин белок, и он гетеродимеризуется с субъединицей Rpp20, АТФазой [[102]]. Следовательно, РНКаза P выполняет нетипичную роль в инициирующих комплексах, возможно, в модификации структуры и функции хроматина [[22, 73]]. Эта возможность подтверждается открытиями, что Rpp21, Rpp29 и Pop1 способны репрессировать дислокацию нуклеосом с помощью гистонового варианта h4.3 в клетках [[103, 104]]. Благодаря взаимодействию с h4.3 и h3B, Rpp29 репрессирует интеграцию гистонов в транскрипционно активные локусы генов рРНК и тРНК [[103, 104]].Более того, мутации в субъединице Rpp30 РНКазы P плодовой мушки приводят к широко распространенным структурным изменениям хроматина из-за стресса репликации в генетических локусах тРНК, что приводит к нарушению экспрессии генов piRNA и, как следствие, к дерепрессии мобильных элементов, нарушающих целостность и стабильность генома. [[105]]. Фактически, связь человеческой РНКазы P с поддержанием генома усиливается открытием, что она участвует в гомологически направленной репарации двухцепочечных разрывов ДНК в человеческих клетках [[90]].Поразительно, но многие белковые субъединицы, включая Rpp14, Rpp25 и Rpp38 этого рибонуклеопротеина, не участвуют в репарации повреждений ДНК [[90]]. Соответственно, специализированная форма РНКазы P участвует в сохранении и поддержании генома [[22]].
Благодаря взаимодействию с h4.3 и h3B, Rpp29 репрессирует интеграцию гистонов в транскрипционно активные локусы генов рРНК и тРНК [[103, 104]].Более того, мутации в субъединице Rpp30 РНКазы P плодовой мушки приводят к широко распространенным структурным изменениям хроматина из-за стресса репликации в генетических локусах тРНК, что приводит к нарушению экспрессии генов piRNA и, как следствие, к дерепрессии мобильных элементов, нарушающих целостность и стабильность генома. [[105]]. Фактически, связь человеческой РНКазы P с поддержанием генома усиливается открытием, что она участвует в гомологически направленной репарации двухцепочечных разрывов ДНК в человеческих клетках [[90]].Поразительно, но многие белковые субъединицы, включая Rpp14, Rpp25 и Rpp38 этого рибонуклеопротеина, не участвуют в репарации повреждений ДНК [[90]]. Соответственно, специализированная форма РНКазы P участвует в сохранении и поддержании генома [[22]].
Инициирующие комплексы типа II и активность процессинга тРНК
Выяснение точной роли РНКазы Р человека в экспрессии различных генов малых некодирующих РНК является сложной задачей. Таким образом, в случае экспрессии генов 5S рРНК этот рибонуклеопротеин исключительно связан с транскрипцией, как указано выше.Напротив, экспрессия тРНК включает транскрипцию и процессинг растущей тРНК предшественника, две задачи, которые, как известно, требуют интактной РНКазы P [[72, 73]]. Но как РНКаза P решает две задачи, которые изучались отдельно в ядерных и целых экстрактах человеческих клеток [[12, 72, 73, 106, 107]]. Недавняя работа показывает, что очищенные инициирующие комплексы, собранные на человеческом интрон-содержащем гене тРНК, осуществляют транскрипцию и процессинг растущей тРНК-предшественницы [[106]]. Обработка включает удаление 5′-лидера, 3′-концевого фрагмента и короткого интрона [[106]].Несмотря на то, что эти ферментативные активности, вероятно, соответствуют активности РНКазы P, РНКазы Z и комплекса сплайсинга тРНК, для заключения результатов необходима дальнейшая работа, которая включает генетические, обратные генетические и спасательные эксперименты (Ramanathan A.
Таким образом, в случае экспрессии генов 5S рРНК этот рибонуклеопротеин исключительно связан с транскрипцией, как указано выше.Напротив, экспрессия тРНК включает транскрипцию и процессинг растущей тРНК предшественника, две задачи, которые, как известно, требуют интактной РНКазы P [[72, 73]]. Но как РНКаза P решает две задачи, которые изучались отдельно в ядерных и целых экстрактах человеческих клеток [[12, 72, 73, 106, 107]]. Недавняя работа показывает, что очищенные инициирующие комплексы, собранные на человеческом интрон-содержащем гене тРНК, осуществляют транскрипцию и процессинг растущей тРНК-предшественницы [[106]]. Обработка включает удаление 5′-лидера, 3′-концевого фрагмента и короткого интрона [[106]].Несмотря на то, что эти ферментативные активности, вероятно, соответствуют активности РНКазы P, РНКазы Z и комплекса сплайсинга тРНК, для заключения результатов необходима дальнейшая работа, которая включает генетические, обратные генетические и спасательные эксперименты (Ramanathan A. and Mani D., в процессе подготовки). Тем не менее, предварительные результаты показывают, что очищенные инициирующие комплексы типа II имеют высокую молекулярную массу 2–3 × 10 6 (Раманатан А. и Мани Д., неопубликованные данные), достаточно большую для размещения РНКазы P (~ 500 кДа), РНКаза Z (~ 85 кДа), комплекс тРНК-эндонуклеаз (~ 190 кДа) и комплекс тРНК-лигаза (~ 300 кДа) [[108]] вместе с Pol III (~ 700 кДа) [[68]], TFIIIB и TFIIIC и другие вспомогательные факторы транскрипции.Масс-спектрометрические анализы подтверждают присутствие многочисленных компонентов фермента тРНК, включая лигазу HSPC117 и белок La, в эффективных комплексах инициации, таким образом поддерживая сочетание нескольких ферментативных активностей для биосинтеза тРНК (Ramanathan A., Mani D., and Abu Ghannam N., неопубликованные данные). В поддержку координации процессинга с транскрипцией очищенные инициирующие комплексы типа II, полученные из экстрактов трансфицированных клеток, экспрессирующих экзогенный POLR3E (RPC5), белковую субъединицу Pol III, обнаруживают сопутствующее увеличение транскрипции и созревания тРНК [[106]].
and Mani D., в процессе подготовки). Тем не менее, предварительные результаты показывают, что очищенные инициирующие комплексы типа II имеют высокую молекулярную массу 2–3 × 10 6 (Раманатан А. и Мани Д., неопубликованные данные), достаточно большую для размещения РНКазы P (~ 500 кДа), РНКаза Z (~ 85 кДа), комплекс тРНК-эндонуклеаз (~ 190 кДа) и комплекс тРНК-лигаза (~ 300 кДа) [[108]] вместе с Pol III (~ 700 кДа) [[68]], TFIIIB и TFIIIC и другие вспомогательные факторы транскрипции.Масс-спектрометрические анализы подтверждают присутствие многочисленных компонентов фермента тРНК, включая лигазу HSPC117 и белок La, в эффективных комплексах инициации, таким образом поддерживая сочетание нескольких ферментативных активностей для биосинтеза тРНК (Ramanathan A., Mani D., and Abu Ghannam N., неопубликованные данные). В поддержку координации процессинга с транскрипцией очищенные инициирующие комплексы типа II, полученные из экстрактов трансфицированных клеток, экспрессирующих экзогенный POLR3E (RPC5), белковую субъединицу Pol III, обнаруживают сопутствующее увеличение транскрипции и созревания тРНК [[106]]. Эта связь прямая, поскольку очищенные инициирующие комплексы, содержащие мутантный POLR3E, который имеет рецессивную замену мутации D40H, почти неактивны в процессинге первичной тРНК [[106]]. Напротив, транскрипция, процессинг и модификации тРНК косвенно связаны в saccharomyces cerevisiae, то есть транскрипция в ядре, тогда как сплайсинг на поверхности митохондрий (см. Обзор [[109]]).
Эта связь прямая, поскольку очищенные инициирующие комплексы, содержащие мутантный POLR3E, который имеет рецессивную замену мутации D40H, почти неактивны в процессинге первичной тРНК [[106]]. Напротив, транскрипция, процессинг и модификации тРНК косвенно связаны в saccharomyces cerevisiae, то есть транскрипция в ядре, тогда как сплайсинг на поверхности митохондрий (см. Обзор [[109]]).
Ко-транскрипционный процессинг РНК: полный или частичный режим
Pol III — одна из трех РНК-полимераз, обнаруженных в ядре; два других — Pol I и Pol II, которые синтезируют рРНК и мРНК соответственно [[60, 62, 63, 101]].Pol I транскрибирует сотни генов рРНК, структура и расположение которых в тандемных повторах консервативны от дрожжей до человека [[110-112]]. Pol I действует в плотном фибриллярном центре ядрышка, в высококонденсированном компартменте, который служит фабрикой транскрипции для производства рибосом. Вновь синтезированная рРНК-предшественник процессируется с образованием зрелой 18S рРНК, 5,8S рРНК и 28S рРНК, которые собираются с r-белками и другими факторами с образованием малых и больших рибосомных субъединиц [[111]].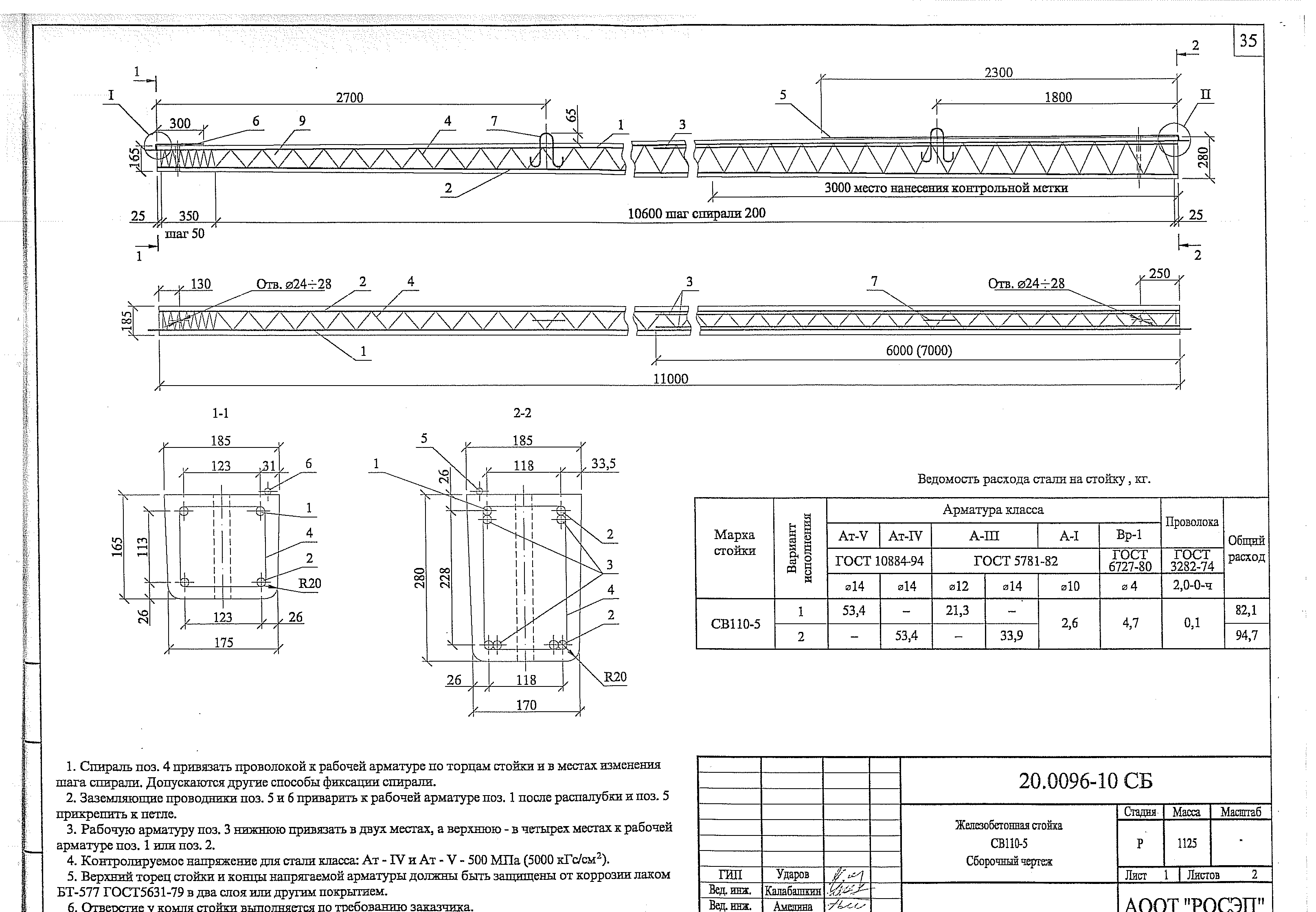 Процессинг предшественника рРНК переключается из котранскрипционного режима в посттранскрипционный в зависимости от роста и пролиферации клеток [[111, 113-118]].Таким образом, расщепление по сайту A 2 во внутреннем транскрибируемом спейсере 1, который отделяет предшественник 40S малой рибосомной субъединицы от предшественника 60S большой рибосомной субъединицы, происходит до завершения транскрипции у быстрорастущих почкующихся дрожжей. Поскольку расщепление сайта A 2 предшествует этому по сайтам A 0 и A 1 , удаление расположенного выше 5′-внешнего транскрибируемого спейсера первичной рРНК происходит котранскрипционно [[114, 118]].Расщепления происходят в процессоме малой субъединицы [[119]], который может быть визуализирован в распространении хроматина (Миллер) в виде концевых выступов на формирующихся рРНК-предшественниках, выступающих из хроматина генов рРНК [[110, 116, 119, 120]] . Компоненты t-Utp процессинга связывают процессинг с транскрипцией предшественника рРНК [[121]].
Процессинг предшественника рРНК переключается из котранскрипционного режима в посттранскрипционный в зависимости от роста и пролиферации клеток [[111, 113-118]].Таким образом, расщепление по сайту A 2 во внутреннем транскрибируемом спейсере 1, который отделяет предшественник 40S малой рибосомной субъединицы от предшественника 60S большой рибосомной субъединицы, происходит до завершения транскрипции у быстрорастущих почкующихся дрожжей. Поскольку расщепление сайта A 2 предшествует этому по сайтам A 0 и A 1 , удаление расположенного выше 5′-внешнего транскрибируемого спейсера первичной рРНК происходит котранскрипционно [[114, 118]].Расщепления происходят в процессоме малой субъединицы [[119]], который может быть визуализирован в распространении хроматина (Миллер) в виде концевых выступов на формирующихся рРНК-предшественниках, выступающих из хроматина генов рРНК [[110, 116, 119, 120]] . Компоненты t-Utp процессинга связывают процессинг с транскрипцией предшественника рРНК [[121]]. Скорость элонгации транскрипции с помощью Pol I и сворачивание растущей рРНК-предшественницы контролируют переключение между частичным котранскрипционным режимом и посттранскрипционным режимом [[111, 117, 122-125]].Переключение могло быть вызвано в условиях низкого деления клеток и нарушения сборки рибосом, тем самым указывая на динамическое созревание рРНК [[114, 126]].
Скорость элонгации транскрипции с помощью Pol I и сворачивание растущей рРНК-предшественницы контролируют переключение между частичным котранскрипционным режимом и посттранскрипционным режимом [[111, 117, 122-125]].Переключение могло быть вызвано в условиях низкого деления клеток и нарушения сборки рибосом, тем самым указывая на динамическое созревание рРНК [[114, 126]].
Сопряжение процессинга с транскрипцией не ограничивается рРНК в эукариотических клетках. Таким образом, транскрипция, процессинг и модификации мРНК полностью связаны [[127-129]], охватывая кэппинг, сплайсинг, редактирование, расщепление 3’-конца, полиаденилирование, деградацию и экспорт [[130-142]]. Ферменты, которые выполняют эти взаимосвязанные события, рекрутируются в формирующиеся транскрипты с помощью карбоксиконцевого домена (CTD) каталитической субъединицы RPB1 Pol II [[143-147]].Этот домен, который состоит из гептадных повторов YSPTSPS и подвергается сайт-специфическому фосфорилированию на всех этапах транскрипции, служит загрузочной площадкой для процессинга и модификации ферментов [[145]]. Для ко-транскрипционного процессинга Pol II находится в организованных жидкоподобных каплях [[148]], представляющих транскрипционные фабрики в нуклеоплазме [[149]]. Капли функционально делятся на конденсаты динамических промоторов и конденсаты временных тел генов [[148, 150-152]].В конденсатах концентрируются компоненты фабрик транскрипции [[151, 152]]. Конденсаты динамических промоторов поддерживают инициацию, имея нефосфорилированный Pol II, факторы инициации, соактиваторы и другие. Конденсаты тела преходящих генов поддерживают удлинение за счет фосфорилированного Pol II, факторов элонгации, коактиваторов, факторов процессинга и возникающих мРНК предшественников [[148, 152]]. Как и в случае с рРНК, созревание мРНК реагирует на изменение условий роста клеток и продукции белка [[153]].
Для ко-транскрипционного процессинга Pol II находится в организованных жидкоподобных каплях [[148]], представляющих транскрипционные фабрики в нуклеоплазме [[149]]. Капли функционально делятся на конденсаты динамических промоторов и конденсаты временных тел генов [[148, 150-152]].В конденсатах концентрируются компоненты фабрик транскрипции [[151, 152]]. Конденсаты динамических промоторов поддерживают инициацию, имея нефосфорилированный Pol II, факторы инициации, соактиваторы и другие. Конденсаты тела преходящих генов поддерживают удлинение за счет фосфорилированного Pol II, факторов элонгации, коактиваторов, факторов процессинга и возникающих мРНК предшественников [[148, 152]]. Как и в случае с рРНК, созревание мРНК реагирует на изменение условий роста клеток и продукции белка [[153]].
Биосинтез тРНК, вероятно, следует за частичным или полным процессингом котранскрипции в клетках человека. Эта концепция подтверждается несколькими выводами. Во-первых, он включает ассоциацию Pol III с активностью процессинга тРНК в опытных комплексах инициации (Fig. 2), как описано выше [[106]]. Кроме того, очищенные комплексы повторной инициации с коммитированным Pol III сохраняют РНКазу P [[73]], делая растущий субстрат близким к эндорибонуклеазе. Pol III выполняет повторную инициацию посредством облегченного механизма рециклинга, перезагрузки связанной полимеразы в тот же ген тРНК [[101, 154, 155]].Облегченный рециклинг делает возможной однонаправленную транскрипцию и защиту полимеразы от репрессии Maf1 [[155]]. В этом контексте Pol II также подвергается рециклингу через петли генов, с помощью которых промоторы связываются с участками терминации посредством образования петель ДНК [[156]]. Во-вторых, кластеризация генов тРНК в определенном компартменте у дрожжей [[88, 89]] подтверждает существование фабрик транскрипции для Pol III [[99]], в которых машины транскрипции и процессинга собраны и действуют вместе, как в случае с фабриками транскрипции Pol II [[149, 152]].В-третьих, субъединица Rpc11p Pol III Schizosaccharomyces pombe связывает терминацию транскрипции с расщеплением 3′-тРНК, тем самым ограничивая длину поли-U-хвоста в формирующихся тРНК-предшественниках и процессинг через La-независимый путь [[35]].
2), как описано выше [[106]]. Кроме того, очищенные комплексы повторной инициации с коммитированным Pol III сохраняют РНКазу P [[73]], делая растущий субстрат близким к эндорибонуклеазе. Pol III выполняет повторную инициацию посредством облегченного механизма рециклинга, перезагрузки связанной полимеразы в тот же ген тРНК [[101, 154, 155]].Облегченный рециклинг делает возможной однонаправленную транскрипцию и защиту полимеразы от репрессии Maf1 [[155]]. В этом контексте Pol II также подвергается рециклингу через петли генов, с помощью которых промоторы связываются с участками терминации посредством образования петель ДНК [[156]]. Во-вторых, кластеризация генов тРНК в определенном компартменте у дрожжей [[88, 89]] подтверждает существование фабрик транскрипции для Pol III [[99]], в которых машины транскрипции и процессинга собраны и действуют вместе, как в случае с фабриками транскрипции Pol II [[149, 152]].В-третьих, субъединица Rpc11p Pol III Schizosaccharomyces pombe связывает терминацию транскрипции с расщеплением 3′-тРНК, тем самым ограничивая длину поли-U-хвоста в формирующихся тРНК-предшественниках и процессинг через La-независимый путь [[35]]. В-четвертых, интегральные белки ядерных пор действуют, чтобы координировать транскрипцию и процессинг тРНК у нематод Caenorhabditis elegans [[157]].
В-четвертых, интегральные белки ядерных пор действуют, чтобы координировать транскрипцию и процессинг тРНК у нематод Caenorhabditis elegans [[157]].
Схематическая модель инициирующего комплекса типа II человека, собранного на интрон-содержащем гене тРНК.Ген тРНК имеет внутренний промотор с двумя основными регуляторными элементами, боксом А и боксом B, связанным с основными факторами транскрипции TFIIIB и TFIIIC. Эти два фактора привлекают Pol III к гену. Полимераза инициирует транскрипцию с начальной точки (стрелка) и заканчивается коротким терминатором поли-Т (ТТТТ). Pol III повторно инициируется посредством облегченного механизма рециклинга, посредством которого он выполняет раунды транскрипции, не покидая гена.
| Функциональный ключ | Позиция (я) | Описание Действия | Графическое представление | Длина |
|---|---|---|---|---|
В этом подразделе раздела «Последовательность» сообщается о различиях между канонической последовательностью (отображаемой по умолчанию в записи) и различными отправленными последовательностями, объединенными в записи.Эти различные материалы могут исходить из разных проектов секвенирования, разных типов экспериментов или разных биологических образцов. | 21 | D → N в AAF00616 (PubMed: 10489374). | 1 | |
| Функциональный ключ | Позиция (я) | Описание Действия | Графический вид | Длина |
В этом подразделе раздела «Последовательность» описывается последовательность встречающейся в природе альтернативной изоформы (ов) белка.Изменения в аминокислотной последовательности могут быть связаны с альтернативным сплайсингом, использованием альтернативного промотора, альтернативной инициацией или рибосомным сдвигом рамки. Альтернативная последовательность i VSP_006961 | 1 — 115 | Отсутствует в изоформе 1S, изоформе 2S, изоформе 3S, изоформе 4S, изоформе 5S, изоформе 6S, изоформе 7S и изоформе 8S. Информация, подобранная вручную, основанная на утверждениях в научных статьях, для которых нет экспериментальной поддержки. Утверждение вручную на основе заключения в i
| 115 | |
| Альтернативная последовательность я VSP_006960 | 359 — 384 | ETNWP … SSSPA → DPGSPKKCRARFGLNQQTDW CGPCRRKKKCIRYLPGEGRC PSPVPSDDSALGCPGSPAPQ DSPSYHLLPRFPTELLTSPA ERHLHPQVSPLLSASQPQGP HRPPAAPCRAHRYSNRNLRD RWPSRHRTPGRLQEPTP в изоформы 1L и изоформ 1S.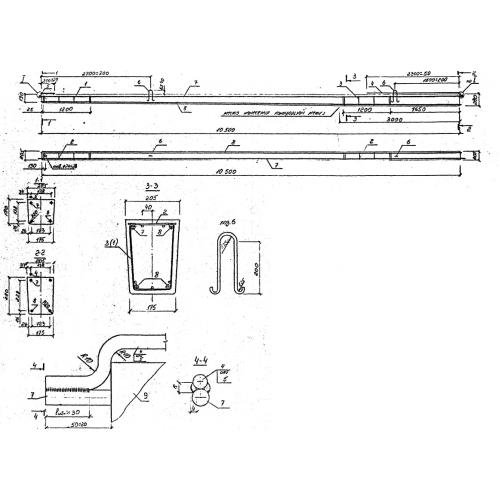 Добавить BLAST Добавить BLAST | 26 | |
| Альтернативная последовательность i VSP_002191 | 359 — 384 | ETNWP… SSSPA → GGKRNAFGTYPEKAAAPF LPMTVL в изоформе 2S и изоформе 2L. Ручное утверждение, основанное на мнении в i
| 26 | |
| Альтернативная последовательность i VSP_002192 | 359 — 384 | ETNWP… SSSPA → DPGSPKKCRARFGLormNQQTDW 3 и isof CGДобавить BLAST | 26 | |
| Альтернативная последовательность i VSP_012160 | 359 — 384 | ETNWP… SSSPA → DNSLHYS в изоформе 5L и изоформе 5S. Руководство утверждение основано на мнении в я Добавить BLAST | 26 | |
| Альтернативная последовательность я VSP_012161 | 359 — 384 | ETNWP … SSSPA → DPGSPKKCRARFGLNQQTDW CGPCRKKKCIRYLPGEGRCP SPVPSDDSALGCPGSPAPQD SPSYHLLPRFPTELLTSPAE RHLHPQVSPLLSASQPQGPH RPPAAPCRAHRYSNRNLRDR WPSRHRTPGRLQEPTP в изоформы 6L и изоформа 6S. Ручное утверждение, основанное на мнении в i Добавить BLAST | 26 | |
| Альтернативная последовательность i VSP_012162 | 359 — 384 | ETNWPL… Ручное утверждение на основе заключения в i Добавить BLAST | 26 | |
| Альтернативная последовательность i VSP_012163 | 359 — 384 | ETNWP… SSSPA в форме 8KLEDWD и в форме 8KLEDWD Ручное утверждение, основанное на мнении в i Добавить BLAST | 26 |
(PDF) Регулирование транскрипции РНК-полимеразы III во время гипертрофического роста
(2000) Сигнальный путь MEK1-Erk1 / 2 способствует развитию com-
пенсированная гипертрофия сердца у трансгенных мышей. EMBO J 19:
6341–6350
Bueno OF, Molkentin JD (2002) Участие внеклеточных
сигнально-регулируемых киназ 1/2 1/2 в сердечной гипертрофии и гибели клеток.S, Sheikh SP
(2002) Участие циклина D в гипертрофии левого желудочка
in vivo и in vitro. Cardiovasc Res 56: 64–75
Cairns CA, White RJ (1998) P53 является общим репрессором транскрипции РНК
полимеразы III. EMBO J 17: 3112–3123
Chien KR, Knowlton KU, Zhu H, Chien S (1991) Регулирование экспрессии
сердечных генов во время роста миокарда и гипер-
трофеев: молекулярные исследования адаптивного физиологического ответа.
FASEB J 5: 3037–3046
Chu WM, Wang Z, Roeder RG, Schmid CW (1997) РНК-полимераза
III транскрипция репрессируется RB посредством его взаимодействий с
TFIIIB и TFIIIC2. J Biol Chem 272: 14755–14761
Daly NL, Arvanitis DA, Fairley JA, Gomez-Roman N, Morton JP,
Graham SV, Spandidos DA, White RJ (2005) Дерегуляция РНК
транскрипция полимеразы III в шейке матки эпителий в ответ на
вируса папилломы человека высокого риска.Онкоген 24: 880–888
Fairley JA, Kantidakis T, Kenneth NS, Intine RV, Maraia RJ, White RJ
(2005) Человеческий La обнаружен в транскрибированных РНК-полимеразой III
генах in vivo. Proc Natl Acad Sci USA 102: 18350–18355
Fairley JA, Scott PH, White RJ (2003) TFIIIB фосфорилируется,
разрушается и селективно высвобождается из промоторов тРНК во время митоза–in vivo. EMBO J 22: 5841–5850
Felton-Edkins ZA, Fairley JA, Graham EL, Johnston IM, White RJ,
Scott PH (2003) Киназа митоген-активированного протеина (MAP) Erk
индуцирует синтез тРНК путем фосфорилирования TFIIIB. EMBO J 22:
EMBO J 22:
2422–2432
Glennon PE, Kaddoura S, Sale EM, Sale GJ, Fuller SJ, Sugden P
(1996) Истощение митоген-активированной протеинкиназы с использованием
антисмыслового олигодезоксинуклеотида3
фенилэфрин-индуцированный гипертрофический ответ сердца крыс
миоцитов. Circ Res 78: 954–961
Gomez-Roman N, Grandori C, Eisenman RN, White RJ (2003)
Прямая активация транскрипции РНК-полимеразы III с помощью c-Myc.
Nature 421: 290–294
Ханнан Р.Д., Дженкинс А., Дженкинс А.К., Бранденбургер Ю. (2003)
Гипертрофия сердца: вопрос перевода. Clin Exp Pharm
Physiol 30: 517–527
Hannan RD, Luyken J, Rothblum LI (1995) Регулирование факторов транскрипции рДНК
во время гипертрофии кардиомиоцитов, индуцированной
адренергическими агентами. J Biol Chem 270: 8290–8297
Hannan RD, Luyken J, Rothblum LI (1996) Регулирование транскрипции рибосомной ДНК
во время гипертрофии, вызванной сокращением
неонатальных кардиомиоцитов. J Biol Chem 271: 3213–3220
J Biol Chem 271: 3213–3220
Hannan RD, Rothblum LI (1995) Регулирование транскрипции рибосомной ДНК
во время гипертрофии кардиомиоцитов новорожденных.
Cardiovasc Res 30: 501–510
He T-C, Zhou S, da Costa LT, Yu J, Kinzler KW, Vogelstein B (1998) A
Упрощенная система для создания рекомбинантных аденовирусов. Proc
Natl Acad Sci USA 95: 2509–2514
Hurford RK, Cobrinik D, Lee MH, Dyson N (1997) pRB и p107 /
p130 необходимы для регулируемой экспрессии различных наборов
чувствительных к E2F генов. .Genes Dev 11: 1447–1463
Iijima Y, Laser M, Shiraishi H, Willey CD, Sundaravadivel B, Xu L,
McDermott PJ, Kuppuswamy D (2002) Путь c-Raf / MEK / Erk
контролирует протеинкиназу C-опосредованная активация p70S6K в взрослых
клетках сердечной мышцы. J Biol Chem 277: 23065–23075
Larminie CGC, Cairns CA, Mital M, Martin K, Kouzarides T, Jackson
SP, White RJ (1997) Механистический анализ регуляции РНК-полимеразы III
белком ретинобластомы. EMBO J 16: 2061–2071
EMBO J 16: 2061–2071
Levy D, Garrison RJ, Savage DD, Kannel WB, Castelli WP (1990)
Прогностические последствия эхокардиографически определенной массы левого желудочка
в Framingham Heart Study. N Engl J Med
322: 1561–1566
Li F, Wang X, Capasso JM, Gerdes AM (1996) Быстрый переход
сердечных миоцитов от гиперплазии к гипертрофии во время постнатального развития. J Mol Cell Cardiol 28: 1737–1746
Luyken J, Hannan RD, Cheung JY, Rothblum LI (1996) Регулирование транскрипции
рДНКво время индуцированной эндотелином-1 гипертрофии
кардиомиоцитов новорожденных: гиперфосфорилирование
восходящего фактора связывания
, фактор транскрипции рДНК.Circ Res 78: 354–361MacLellan WR, Xiao G, Abdellatif M, Schneider MD (2000). Новый
Rb- и p300-связывающий белок ингибирует трансактивацию myoD.
Mol Cell Biol 20: 8903–8915
McDermott PJ, Carl LL, Conner KJ, Allo SN (1991) Транскрипционная
регуляция синтеза рибосомной РНК во время роста сердечных
миоцитов в культуре. J Biol Chem 266: 4409–4416
Mittnacht S (2005) Белок ретинобластомы — от скамьи до постели
.Eur J Cell Biol 84: 97–107
Nozato T, Ito H, Watanabe M, Ono Y, Adachi S, Tanaka H, Hiroe M,
Sunamori M, Marumo F (2001) Сверхэкспрессия ингибитора cdk
p16
INK4a
с помощью аденовирусного вектора подавляет гипертрофию сердца
in vitro и in vivo: новая стратегия генной терапии гипертрофии сердца
. J Mol Cell Cardiol 33: 1493–1504
Rockman HA, Wachhorst SP, Mao L, Ross Jr J (1994) Блокада рецепторов ANG II
предотвращает гипертрофию желудочков и экспрессию гена ANF
при перегрузке давлением у мышей.Am J Physiol
266: h3468 – h3475
Sadoshima J, Aoki H, Izumo S (1997) Ангиотензин II и сыворотка
по-разному регулируют экспрессию циклинов, активность cyclin-
-зависимых киназ и фосфорилирование гена ретинобластомы
Продуктв сердечных миоцитах новорожденных крыс. Circ Res 80: 228–241
Schramm L, Hernandez N (2002) Рекрутирование РНК-полимеразы
III на ее промоторы-мишени. Genes Dev 16: 2593–2620
Scott PH, Cairns CA, Sutcliffe JE, Alzuherri HM, McLees A, Winter
AG, White RJ (2001) Регулирование транскрипции РНК-полимеразы III —
во время входа в клеточный цикл.J Biol Chem 276: 1005–1014
Sethy I, Moir RD, Librizzi M, Willis IM (1995) Доказательства in vitro
для регуляции роста транскрипции гена тРНК в дрожжах. J Biol
Chem 270: 28463–28470
Shen Y, Igo M, Yalamanchili P, Berk AJ, Dasgupta A (1996) ДНК
Взаимодействие связывающего домена и субъединиц фактора транскрипции
IIIC, выявленное путем вскрытия с помощью протеазы полиовируса 3C . Mol Cell
Biol 16: 4163–4171
Soonpaa MH, Kim KK, Pajak L, Franklin M, Field LJ (1996)
Синтез ДНК кардиомиоцитов и бинуклеация во время развития мыши
.Am J Physiol 271: h3183 – h3189
Starksen NF, Simpson P, Bishopric N, Coughlin SR, Lee WMF,
Escobedo JA, Williams LT (1986) Гипертрофия сердечных миоцитов
связана с экспрессией протоонкогена c-myc. Proc Natl
Acad Sci USA 83: 8348–8350
Sutcliffe JE, Brown TRP, Allison SJ, Scott PH, White RJ (2000)
Белок ретинобластомы нарушает взаимодействия, необходимые для транскрипции РНК
полимеразы III. Mol Cell Biol 20: 9192–9202
Tamamori M, Ito H, Hiroe M, Terada Y, Marumo F, Ikeda M
(1998) Важные роли для активности G1-циклин-зависимой киназы в развитии гипертрофии кардиомиоцитов
.Am J Physiol 275:
h3036 – h3040
Tamamori-Adachi M, Ito H, Nobori K, Hayashida K, Kawauchi J,
Adachi S, Ikeda MA, Kitajima S (2002) Экспрессия циклина D1
и CDK вызывает гипертрофический рост кардиомиоцитов в культуре
: возможное значение для гипертрофии сердца. Biochem
Biophys Res Comm 296: 274–280
Wang L, Gout I, Proud CG (2001) Перекрестная связь между сигнальными путями Erk
и p70 S6-киназы (S6 K): MEK-зависимые-
дент. активация S6K2 в кардиомиоцитах.J Biol Chem 276:
32670–32677
Wang L, Proud CG (2002a) Передача сигналов Ras / Erk важна для
активации синтеза белка агонистами рецептора, связанного с белком Gq
,во взрослых кардиомиоцитах. Circ Res 91: 821–829
Wang L, Proud CG (2002b) Регулирование фосфорилирования
фактора элонгации 2 посредством MEK-зависимой передачи сигналов у взрослых крыс
кардиомиоцитов. FEBS Lett 531: 285–289
Welsh GI, Proud CG (1992) Регулирование синтеза белка в швейцарских
фибробластах 3T3.Быстрая активация фактора обмена гуанин-нуклеотид-
инсулином и факторами роста. Biochem J 284:
19–23
White RJ (2005) РНК-полимеразы I и III, контроль роста и рак
. Nat Rev Mol Cell Biol 6: 69–78
White RJ, Gottlieb TM, Downes CS, Jackson SP (1995) Mitotic
регуляция комплекса, содержащего ТАТА-связывающий белок. Mol
Cell Biol 15: 1983–1992
White RJ, Stott D, Rigby PWJ (1989) Регулирование транскрипции РНК-полимеразы
III в ответ на дифференцировку стволовых клеток эмбиональной карциномы F9
.Cell 59: 1081–1092
White RJ, Trouche D, Martin K, Jackson SP, Kouzarides T (1996)
Репрессия транскрипции РНК-полимеразы III белком бластомы retino-
. Nature 382: 88–90
Транскрипция Pol III и гипертрофический рост
SJ Goodfellow et al
The EMBO Journal VOL 25
|
NO 7
|
2006 и 2006 Европейская организация молекулярной биологии 1532
Биомолекул | Бесплатный полнотекстовый | snoRNPs: функции в биогенезе рибосом
3.Транскрипция и обработка snoRNAs
SnoRNAs обнаруживаются в различных геномных контекстах, которые в целом делятся на две подразделяемые категории: независимые единицы транскрипции и интронно кодируемые snoRNAs (Figure 3). У дрожжей и растений большинство snoRNAs обнаруживается в виде независимо транскрибируемых генов, либо в виде моноцистронных, либо полицистронных единиц. Первый чаще встречается у дрожжей, а второй — у растений. Некоторые гены snoRNA многоклеточных животных существуют как независимые гены, но они являются одними из наиболее важных (например,g., U3, U8 и RMRP). Большая часть информации о промоторах независимых генов snoRNA поступает от дрожжей, но эти данные все еще отсутствуют. Многие гены дрожжевой snoRNA управляют транскрипцией с TATA-содержащих промоторов ниже A / T богатой области и сайта связывания Rap1 [41]. Rap1 является фактором транскрипции, который также необходим для транскрипции генов рибосомных белков у дрожжей, что может служить для интеграции этих процессов в биогенез рибосом [42]. Впоследствии Tbf1 был идентифицирован как второй фактор транскрипции, необходимый для транскрипции snoRNA [43].У людей структура независимо транскрибируемых промоторов snoRNA в значительной степени неизвестна, хотя некоторый прогресс был достигнут с помощью биоинформатического анализа [44]. Хотя РНК-полимераза II (Pol II) транскрибирует большинство независимо транскрибируемых генов snoRNA, есть несколько важных исключений. У дрожжей все snoRNA транскрибируются с помощью RNA Pol II, за исключением snR52, которая транскрибируется с помощью RNA Pol III [45,46,47]. У многоклеточных животных более независимо транскрибируемые гены snoRNA транскрибируются с помощью РНК-полимеразы III.У Caenorhabditis elegans до 59 генов snoRNA транскрибируются с помощью РНК-полимеразы III [48] и по крайней мере два гена у Drosophila [49]. Особо следует отметить некоторые гомологичные гены snoRNA, которые переключили полимеразы на протяжении всей эволюции. МноРНК U3, критическая мяРНК, необходимая для созревания рРНК (см. Ниже), транскрибируется РНК-полимеразой II у дрожжей и у людей [50,51,52]. Тем не менее, у растений U3 snoRNA транскрибируется с помощью РНК-полимеразы III [53]. У человека RMRP, неканоническая мяРНК, транскрибируется РНК-полимеразой III [54], но у дрожжей ее гомолог, NME1, транскрибируется РНК-полимеразой II [55].После транскрипции пре-snoRNA должны быть обработаны для образования зрелой snoRNA (рис. 3A). Это недавно было описано в прекрасном обзоре [56], поэтому здесь мы рассмотрим только основы. Поскольку большинство дрожжевых snoRNAs транскрибируются как независимые единицы транскрипции, большинство данных относительно созревания этого класса snoRNAs поступает от дрожжей. Терминация транскрипции и образование 3′-конца обеспечивается комплексом Nrd1-Nab3-Sen1 (NNS) и Pcf11 [57,58]. После расщепления 3′-конец экзонуклеолитически обрезается экзосомой с образованием зрелых 3′-концов [59].Изначально 5 ‘конец закрывается канонической крышкой m 7 G. Однако он либо удаляется Rnt1 [60], членом семейства RNase III, либо превращается в триметилгуанозиновый кэп m 2,2,7 G с помощью TGS1 [59]. Если колпачок удален, 5′-конец обрезается экзонуклеазами Rat1 и Xrn1 [61]. Расщепление с помощью Rnt1 происходит котранскрипционно и способствует эффективному процессингу 3′-концов [62]. Высшие эукариоты в значительной степени охватили более тонкий механизм транскрипции snoRNA (Figure 3B).Гены snoRNA многоклеточных животных не транскрибируются как отдельные гены, а в основном находятся в интронах генов-хозяев. Присутствие трех копий мяРНК U14 (SNORD14), локализованных в интронах гена hsc70, было обнаружено у человека, мышей и крыс [63]. Позже было показано, что он процессируется из этих snoRNA и может процессироваться из интронов пре-мРНК в инъекционной системе Xenopus [64]. Более поздняя работа показала, что это не уникальная ситуация, поскольку было идентифицировано, что мяРНК U15 (SNORD15) локализуется в интроне гена RPS3 и процессируется из его пре-мРНК [65].Открытие гена рибосомного белка, содержащего snoRNA, предвещало открытие того, что многие интронно кодируемые snoRNA обнаруживаются в генах, кодирующих рибосомный биогенез или трансляционный аппарат. Например, более трети генов рибосомных белков содержат по крайней мере одну мяРНК. Некоторые гены рибосомных белков являются хозяевами множества snoRNA, таких как RPL7A или RPL13A, каждая из которых содержит четыре snoRNA. Теоретически такая компоновка допускает сопряженный синтез рибосомных белков и мяРНК, которые необходимы для модификации рРНК.Интересный случай корегуляции был показан для NOP56 и snoRD86 [66]. NOP56 является компонентом комплекса SnoRNP Box C / D, который, как предполагалось, функционирует в «блокировке» конечной конформации snoRNPs [67]. Когда уровни белка NOP56 высоки, свободный NOP56 связывается с SNORD86 в интроне пре-мРНК NOP56 и изменяет сплайсинг с образованием мРНК NOP56 с кодоном преждевременной терминации. Таким образом, эта изоформа NOP56 разлагается посредством нонсенс-опосредованного распада (NMD). Альтернативно, когда уровни NOP56 ограничены, SNORD86 не связан, и пре-мРНК NOP56 сплайсируется с образованием мРНК, кодирующей полноразмерный белок.Другой важный набор генов-хозяев — это те, которые, по-видимому, не обладают кодирующим потенциалом, а также, по-видимому, не функционируют как длинные некодирующие (ДНК) РНК. Среди наиболее примечательных является ген хозяина U22 (UHG), который, помимо U22 (SNORD22), содержит семь дополнительных snoRNAs (U25-U31) [68]. Все snoRNA в UHG представляют собой snoRNA Box C / D. После сплайсинга мРНК UHG временно связывается с рибосомами, но затем быстро деградирует с помощью нонсенс-опосредованного распада (NMD), предполагая, что у нее нет другой цели, кроме как служить хозяином для этих восьми snoRNAs.Второй член этого класса был обнаружен вскоре после этого, названный gas5, который содержит 10 snoRNAs (девять у мышей) семейства Box C / D [69]. Подобно UHG, мРНК GAS5 быстро разрушается в нормальных растущих клетках. Однако мРНК GAS5 стабилизирована при многих различных типах рака и, по-видимому, выполняет функции, отличные от ее активности, кодирующей snoRNA [70]. Впоследствии были идентифицированы другие гены-хозяева, такие как U17HG [71], U19HG [72] и U50HG [73]. Поразительно, но все эти мРНК хозяина содержат 5′-концевые олигопиримидиновые (5’TOP) мотивы.Считается, что эти мотивы регулируют трансляцию посредством mTOR-зависимого механизма [74]. Здесь стоит отметить, что все рибосомные белки кодируются мРНК, которые содержат мотивы 5’TOP, потенциально обеспечивая связь между различными классами генов-хозяев мяРНК. Кроме того, недавно были подробно рассмотрены молекулярные сложности удаления мяРНК из интронов [ 56], поэтому здесь мы рассмотрим только основы. Основы процессинга аналогичны основам процессинга независимо транскрибируемых генов snoRNA: после 5 ‘и 3’ процессинга происходит окончательное созревание путем экзонуклеолитического обрезания.Однако это может происходить двумя путями: зависимым от сплайсинга и независимым от сплайсинга путем [75]. Зависимый от сплайсинга путь, по-видимому, является основным путем. Здесь механизм сплайсинга удаляет интрон, оставляя лариат, содержащий пре-snoRNA. На этом пути созревание зависит от линеаризации под действием фермента, разветвляющего ветви [76]. На этом этапе экзонуклеазы от 5 ‘до 3’ и от 3 ‘до 5’ обрезаются для образования зрелых 5 ‘и 3′ концов [77]. Второй, второстепенный путь не зависит от удаления интрона с последующим расщеплением ветвей.Вместо этого стволовая структура формируется в основании пре-snoRNA, которая расщепляется, высвобождая snoRNA из более крупного предшественника [75]. В отличие от независимо транскрибируемых генов snoRNA, интронно кодируемые гены лишены 5′-кэпа вместо того, чтобы содержать 5’-монофосфат, образующийся после экзонуклеолитического обрезания. Сборка snoRNP Box C / D и Box H / ACA требует множества факторов сборки, которые опосредуют образование и доставку РНП. от места транскрипции через тельца Кахаля и к ядрышку.Этот сложный процесс недавно был рассмотрен в [78]. Однако следует отметить один комплекс — шаперонную систему HSP90 / R2TP. Первоначально обнаруженный у дрожжей с помощью протеомного анализа, комплекс R2TP состоит из Rvb1, Rvb2, Tah2 и Pih2 и взаимодействует с HSP90 [79]. Идентификация человеческого комплекса, содержащего гомологи RUVBL1, RUVBL2, RPAP3 и PIh2D1, демонстрирующая, что это консервативный комплекс [80]. Несмотря на наличие неродственных структур РНК и белковых компонентов, этот комплекс помогает в сборке как Box C / D, так и Box H / ACA snoRNPs [81].Истощение RUVBL2 ведет к потере Box C / D и Box H / ACA snoRNAs и к нарушению доставки белков snoRNP в ядрышко [82].Возьмите домашнее сообщение: геномно snoRNAs обнаруживаются как независимые единицы транскрипции или размещаются в интронах мРНК. Оба требуют посттранскрипционной обработки и сборки с белковыми компонентами.
4. Роль модификаций в функции рибосом
Во многих случаях роль модификаций рРНК остается загадочной. Консервация и кластеризация модификаций в функциональных центрах, таких как центр пептидилтрансферазы или интерфейс субъединиц, указывают на их важность.Что касается структуры и стабильности рибосом, 2′-O-метилирование увеличивает гидрофобность, а псевдоуридилирование позволяет создавать дополнительные водородные связи. Оба эти свойства могут стабилизировать взаимодействия или обеспечить жесткость. У дрожжей глобальная потеря либо 2’Ome, либо Ψ, возникающая в результате экспрессии каталитически мертвых мутантов Nop1 (FBL) и Cbf5p (DKC1), приводит к тяжелым фенотипам [12,83]. Инактивация мутаций в DKC1 у млекопитающих (D95A) ожидаемо предотвращает псевдоуридилирование и снижает скорость трансляции и точность [84].Однако предотвращение индивидуальных модификаций посредством отмены одиночной snoRNA редко имеет драматические эффекты [85]. Однако есть некоторые примечания. В дрожжах snR10 катализирует превращение U 2923 в 2923 в 25S рРНК. Делеция этой snoRNA делает клетки более восприимчивыми к осмотическому и холодовому стрессу [86]. Однако немного усложняет эти данные то, что потеря этой snoRNA также снижает эффективность процессинга пре-рРНК (обсуждается ниже) [87]. Тем не менее, наблюдается снижение эффективности трансляции, которое, скорее, связано с модификацией, а не с обработкой [88].Опять же, у дрожжей потеря метилирования U 2918 в 25S рРНК снижает рост и обнаруживает дефекты трансляции [89]. Важность этого метилирования подтверждается тем фактом, что оно депонируется двумя дублирующими механизмами, метилированием, опосредованным snR52 и spb1. Кроме того, метилирование эквивалентного сайта у Escherichia. coli необходима для оптимальной пригодности [90]. Однако важность этих индивидуальных модификаций представляется скорее исключением, чем правилом. Тем не менее, тот факт, что snoRNAs, компоненты snoRNPs и сайты модификации находятся под давлением отбора, подтверждает их важность.Дальнейшая работа продемонстрировала, что многие из этих модификаций не действуют индивидуально, а имеют кумулятивный и синергетический эффект на функцию рибосом. Потеря шести Ψ в пептидилтрансферазном центре большой субъединицы значительно снижает скорость трансляции и сборку полисом [88]. Интерфейс между большой и малой субъединицами происходит между спиралью 69 большой субъединицы и спиралью 44 малой субъединицы [91]. Спираль 69 содержит несколько модифицированных нуклеотидов на участке длиной 11 нуклеотидов (AmCΨAΨGACCΨCΨ).Отмена этих модификаций за счет нарушения snoRNAs нарушает рост клеток, разрушает структуру рибосом и изменяет эффективность трансляции [92]. Кластер депонированных snoRNP модификаций в декодирующем центре большой субъединицы также необходим для эффективной трансляции [93].Возьмите домой сообщение: множественные химические модификации рРНК имеют кумулятивный эффект на активность рибосом.
7. Роль snoRNP-опосредованных модификаций в процессинге рРНК
Понятно, что snoRNA необходимы для процессинга рРНК, особенно те, которые обсуждались выше (e.г., У3, РМРП). Действительно, было показано, что даже те, которые управляют модификацией РНК, играют роль в процессинге рРНК (например, snR10, U13, U14). Однако показ того, что для процессинга требуется конкретная snoRNA, не различает две возможности: (1) взаимодействие snoRNP: рРНК требуется для процессинга или (2) химическая модификация определенных нуклеотидов необходима для процессинга. То есть возможно, что определенные snoRNP действуют как шапероны, изменяя вторичную структуру пре-рРНК, что способствует эффективному расщеплению.Следовательно, взаимодействие snoRNP: рРНК может служить для химической модификации рРНК и изменения вторичной структуры рРНК.
Ранняя работа лаборатории Дарнелла представила данные, демонстрирующие, что 2′-O-метилирование рибосомальной РНК было важно для процессинга пре-рРНК, но не для транскрипции рРНК [165]. Более поздняя работа с использованием этионина, аналога метионина, не способного действовать как донор метила, подтвердила эти результаты [166]. Используя цикло- лейцин, другой ингибитор метилирования, другие предположили, что потеря 2′-O-метилирования задерживает или снижает эффективность процессинга, но не устраняет его полностью [167].Неожиданно, хотя 2′-O-метилирование эволюционно консервативно, необходимости в 2′-O-метилировании при процессинге рРНК может не быть. У E. coli обработка этионином, по-видимому, не влияет на процессинг рРНК [168]. Однако, хотя созревание рРНК не затронуто, субъединицы 50S E. coli, выращенные в этионине, были дефектными, но это, по-видимому, связано с отсутствием метилирования рибосомных белков. Тот факт, что метилирование рРНК не требуется для сборки рибосом E. coli, может не вызывать удивления, поскольку E.рибосомы coli могут быть собраны in vitro с субметилированной рРНК [168]. Кроме того, стоит отметить, что 2′-O-метилирование в E. coli не медитируется snoRNA. Более удивительно то, что у дрожжей некоторые чувствительные к температуре мутанты в Nop1p / FBL, которые влияют на метилирование, не нарушают биогенез рРНК, но действительно предотвращают 2′-O-метилирование [12]. Таким образом, кажется, что высшие эукариоты уникальны в плане необходимости 2′-O-метилирования для созревания рРНК. Было труднее определить роль в процессинге рРНК из-за отсутствия ингибиторов псевдоуридилирования, особенно в позвоночные; однако некоторый прогресс был достигнут.У дрожжей Cbf5p важен для жизнеспособности [169]. Однако экспрессия каталитически мертвого (D95A) Cbf5p в клетках ΔCbf5p может спасти жизнеспособность, но этим клеткам не хватает в рРНК [83]. Несмотря на это, очевидного отсутствия эффекта на процессинг рРНК не наблюдалось. Подобно дрожжам, нокаут DKC1 вызывает эмбриональную летальность у мышей [170], но MEFs, клетки, несущие каталитически мертвые (D125A) мутации, обнаруживают дефекты в процессинге и синтезе рРНК [171]. Эти данные несколько усложняются снижением уровня DKC1 в этих клетках.Несмотря на это, авт. Обнаружили, что зрелая рРНК из клеток DKC1 (D125A) была менее стабильной, утверждая, что играет роль в стабилизации рРНК. В целом, эти данные отражают данные 2′-O-метилирования, при котором требуется для процессинга у высших эукариот, но, по-видимому, более незаменим для дрожжей. Однако, как упомянуто выше, хотя немодифицированная рРНК может созревать, содержащиеся в ней рибосомы являются дефектными. Существуют примеры, такие как вышеупомянутый snR10, в которых snoRNA, которые управляют модификациями, необходимы для процессинга [86,87].Тем не менее, не было твердо установлено, что необходима модификация или требуется гибридизация snoRNA: rRNA для процессинга. Кроме того, псевдоуридилирование snR35 преобразует U 1191 в Ψ 1191 , который далее модифицируется в 1-метил-3-γ- (α-амино-α-карбоксипропил) -псевдоуридин (m 1 acp 3 Ψ). [172]. Эта модификация необходима для нормального процессинга дрожжевой 18S рРНК. Отсутствие преобразования U 1191 в Ψ 1191 предотвращает осаждение m 1 acp 3 .В результате 20S пре-рРНК никогда не созревает до 18S рРНК [93].Возьмите домой сообщение: есть определенные случаи, в которых химическая модификация рРНК помогает в процессинге пре-рРНК, но большинство из них необязательны. Тенденция такова, что эти модификации более необходимы высшим эукариотам, чем дрожжам или бактериям.


 Масса одной единицы опоры составляет 0,75 тн., изгибающий момент 2,0 тс*м.
Масса одной единицы опоры составляет 0,75 тн., изгибающий момент 2,0 тс*м. , изгибающий момент составляет 3,5 тс*м, максимальная загрузка в автомобиль 20 тонн — 18 ед.
, изгибающий момент составляет 3,5 тс*м, максимальная загрузка в автомобиль 20 тонн — 18 ед.


 А., Георгиев Г.П. Вездесущие транспозоноподобные повторы B1 и B2 генома мыши: секвенирование B2.Nucleic Acids Res. 11 декабря 1982 г .; 10 (23): 7461–7475. [Бесплатная статья PMC] [PubMed] [Google Scholar]
А., Георгиев Г.П. Вездесущие транспозоноподобные повторы B1 и B2 генома мыши: секвенирование B2.Nucleic Acids Res. 11 декабря 1982 г .; 10 (23): 7461–7475. [Бесплатная статья PMC] [PubMed] [Google Scholar] [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] Седиментационные характеристики быстро меченой РНК из клеток HeLa. Biochem Biophys Res Commun. 1962 г., 4 июня; 7: 486–490. [PubMed] [Google Scholar]
Седиментационные характеристики быстро меченой РНК из клеток HeLa. Biochem Biophys Res Commun. 1962 г., 4 июня; 7: 486–490. [PubMed] [Google Scholar] А., Букринский М.И., Рысков А.П.Последовательности ДНК, гомологичные длинной двухцепочечной РНК. Транскрипция внутрицистернальных генов А-частиц и большого длинного повтора генома мыши. Biochim Biophys Acta. 3 октября 1985 г., 826 (1): 20–29. [PubMed] [Google Scholar]
А., Букринский М.И., Рысков А.П.Последовательности ДНК, гомологичные длинной двухцепочечной РНК. Транскрипция внутрицистернальных генов А-частиц и большого длинного повтора генома мыши. Biochim Biophys Acta. 3 октября 1985 г., 826 (1): 20–29. [PubMed] [Google Scholar] н., возможно, произошли от генов тРНК. J Mol Evol. 1985. 22 (2): 134–140.[PubMed] [Google Scholar]
н., возможно, произошли от генов тРНК. J Mol Evol. 1985. 22 (2): 134–140.[PubMed] [Google Scholar] Индукция транскрипции B2 РНК-полимеразы III тепловым шоком: обогащение последовательностей, индуцированных тепловым шоком, в клетках грызунов путем вычитания гибридизации.Nucleic Acids Res. 25 июля 1986 г .; 14 (14): 5793–5811. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Индукция транскрипции B2 РНК-полимеразы III тепловым шоком: обогащение последовательностей, индуцированных тепловым шоком, в клетках грызунов путем вычитания гибридизации.Nucleic Acids Res. 25 июля 1986 г .; 14 (14): 5793–5811. [Бесплатная статья PMC] [PubMed] [Google Scholar] [Бесплатная статья PMC] [PubMed] [Google Scholar]
[Бесплатная статья PMC] [PubMed] [Google Scholar] J Biol Chem. 10 июля 1983 г .; 258 (13): 8352–8356. [PubMed] [Google Scholar]
J Biol Chem. 10 июля 1983 г .; 258 (13): 8352–8356. [PubMed] [Google Scholar] Конфликты последовательностей обычно имеют неизвестное происхождение.
Конфликты последовательностей обычно имеют неизвестное происхождение. , Канда К., Йокои Т., Фуруя Т., Киккава Э., Омура Ю., Абе К., Камихара К., Кацута Н., Сато К., Таникава М., Ямадзаки М., Ниномия К., Исибаши Т., Ямасита Х., Муракава К., Фудзимори К., Танай Х., Кимата М., Ватанабэ М., Хираока С., Чиба Ю., Исида С., Оно Ю., Такигучи С., Ватанабэ С., Йосида М., Хотута Т., Кусано Дж., Канехори К., Такахаши-Фуджи А., Хара Х., Танасэ Т.-О., Номура Ю., Тогия С., Комаи Ф., Хара Р., Такеучи К., Арита М., Имосе Н. ., Мусасино К., Юки Х., Осима А., Сасаки Н., Аотсука С., Йошикава Ю., Мацунава Х., Итихара Т., Шиохата Н., Сано С., Мория С., Момияма Х., Сато Н., Таками С., Терашима Ю., Судзуки О., Накагава С., Сено А., Мидзогути Х., Гото Ю., Симидзу Ф., Вакебе Х., Хишигаки Х., Ватанабэ Т., Сугияма А., Такемото М., Каваками Б., Ямадзаки М., Ватанабе К., Кумагаи А., Итакура С., Фукузуми Ю., Фудзимори Ю., Комияма М., Таширо Х., Танигами А., Фудзивара Т., Оно Т., Ямада К., Фуджи Ю., Одзаки К., Хирао М., Омори Ю., Кавабата А. , Хикиджи Т., Кобатаке Н., Инагаки Х., Икема Ю.
, Канда К., Йокои Т., Фуруя Т., Киккава Э., Омура Ю., Абе К., Камихара К., Кацута Н., Сато К., Таникава М., Ямадзаки М., Ниномия К., Исибаши Т., Ямасита Х., Муракава К., Фудзимори К., Танай Х., Кимата М., Ватанабэ М., Хираока С., Чиба Ю., Исида С., Оно Ю., Такигучи С., Ватанабэ С., Йосида М., Хотута Т., Кусано Дж., Канехори К., Такахаши-Фуджи А., Хара Х., Танасэ Т.-О., Номура Ю., Тогия С., Комаи Ф., Хара Р., Такеучи К., Арита М., Имосе Н. ., Мусасино К., Юки Х., Осима А., Сасаки Н., Аотсука С., Йошикава Ю., Мацунава Х., Итихара Т., Шиохата Н., Сано С., Мория С., Момияма Х., Сато Н., Таками С., Терашима Ю., Судзуки О., Накагава С., Сено А., Мидзогути Х., Гото Ю., Симидзу Ф., Вакебе Х., Хишигаки Х., Ватанабэ Т., Сугияма А., Такемото М., Каваками Б., Ямадзаки М., Ватанабе К., Кумагаи А., Итакура С., Фукузуми Ю., Фудзимори Ю., Комияма М., Таширо Х., Танигами А., Фудзивара Т., Оно Т., Ямада К., Фуджи Ю., Одзаки К., Хирао М., Омори Ю., Кавабата А. , Хикиджи Т., Кобатаке Н., Инагаки Х., Икема Ю. , Окамото С., Окитани Р., Каваками Т., Ногути С., Ито Т., Сигета К., Сенба Т., Мацумура К., Накадзима Ю., Мизуно Т., Моринага М., Сасаки М., Тогаши Т., Ояма М., Хата Х., Ватанабэ М., Комацу Т., Мидзусима-Сугано Дж., Сато Т., Шираи Ю., Такахаши Ю., Накагава К., Окумура К., Нагасе Т., Номура Н., Кикучи Х. , Масухо Ю., Ямасита Р., Накай К., Яда Т., Накамура Ю., Охара О., Исогай Т., Сугано С.
, Окамото С., Окитани Р., Каваками Т., Ногути С., Ито Т., Сигета К., Сенба Т., Мацумура К., Накадзима Ю., Мизуно Т., Моринага М., Сасаки М., Тогаши Т., Ояма М., Хата Х., Ватанабэ М., Комацу Т., Мидзусима-Сугано Дж., Сато Т., Шираи Ю., Такахаши Ю., Накагава К., Окумура К., Нагасе Т., Номура Н., Кикучи Х. , Масухо Ю., Ямасита Р., Накай К., Яда Т., Накамура Ю., Охара О., Исогай Т., Сугано С.  , Сато К., Таникава М., Ямадзаки М., Ниномия К., Исибаши Т., Ямасита Х., Муракава К., Фуджимори К., Танай Х., Кимата М., Ватанабэ М., Хираока С., Чиба И., Исида С., Оно Ю., Такигучи С., Ватанабэ С., Йосида М., Хотута Т., Кусано Дж., Канехори К., Такахаши -Fujii A., Hara H., Tanase T.-O., Nomura Y., Togiya S., Komai F., Hara R., Takeuchi K., Arita M., Imose N., Musashino K., Yuuki H. ., Осима А., Сасаки Н., Аотсука С., Йошикава Ю., Мацунава Х., Итихара Т., Шиохата Н., Сано С., Мория С., Момияма Х., Сато Н., Таками С., Терасима Ю., Судзуки О., Накагава С., Сено А., Мидзогути Х., Гото Ю., Симидзу Ф., Вакебе Х., Хисигаки Х., Ватанабэ Т., Сугияма А., Такемото М., Каваками Б., Ямадзаки М., Ватанабе К., Кумагаи А., Итакура С., Фукузуми Ю., Фудзимори Ю., Комияма М., Таширо Х., Танигами А., Фудзивара Т., Оно Т., Ямада К., Фуджи Ю., Одзаки К., Хирао М., Омори Ю., Кавабата А., Хикиджи Т., Кобатаке Н. , Инагаки Х., Икема Ю., Окамото С., Окитани Р., Каваками Т., Ногучи С., Ито Т., Сигета К., Сенба Т.
, Сато К., Таникава М., Ямадзаки М., Ниномия К., Исибаши Т., Ямасита Х., Муракава К., Фуджимори К., Танай Х., Кимата М., Ватанабэ М., Хираока С., Чиба И., Исида С., Оно Ю., Такигучи С., Ватанабэ С., Йосида М., Хотута Т., Кусано Дж., Канехори К., Такахаши -Fujii A., Hara H., Tanase T.-O., Nomura Y., Togiya S., Komai F., Hara R., Takeuchi K., Arita M., Imose N., Musashino K., Yuuki H. ., Осима А., Сасаки Н., Аотсука С., Йошикава Ю., Мацунава Х., Итихара Т., Шиохата Н., Сано С., Мория С., Момияма Х., Сато Н., Таками С., Терасима Ю., Судзуки О., Накагава С., Сено А., Мидзогути Х., Гото Ю., Симидзу Ф., Вакебе Х., Хисигаки Х., Ватанабэ Т., Сугияма А., Такемото М., Каваками Б., Ямадзаки М., Ватанабе К., Кумагаи А., Итакура С., Фукузуми Ю., Фудзимори Ю., Комияма М., Таширо Х., Танигами А., Фудзивара Т., Оно Т., Ямада К., Фуджи Ю., Одзаки К., Хирао М., Омори Ю., Кавабата А., Хикиджи Т., Кобатаке Н. , Инагаки Х., Икема Ю., Окамото С., Окитани Р., Каваками Т., Ногучи С., Ито Т., Сигета К., Сенба Т. , Мацумура К., Накадзима Ю., Мидзуно Т., Моринага М., Сасаки М., Тогаши Т., Ояма М., Хата Х., Ватанабэ М., Komatsu T., Mizushima-Sugano J., Satoh T., Shirai Y., Takahashi Y., Nakagawa K., Okumura K., Nagase T., Nomura N., Kikuchi H., Masuho Y., Yamashita R. , Накай К., Яда Т., Накамура Ю., Охара О., Исогай Т., Сугано С.
, Мацумура К., Накадзима Ю., Мидзуно Т., Моринага М., Сасаки М., Тогаши Т., Ояма М., Хата Х., Ватанабэ М., Komatsu T., Mizushima-Sugano J., Satoh T., Shirai Y., Takahashi Y., Nakagawa K., Okumura K., Nagase T., Nomura N., Kikuchi H., Masuho Y., Yamashita R. , Накай К., Яда Т., Накамура Ю., Охара О., Исогай Т., Сугано С.